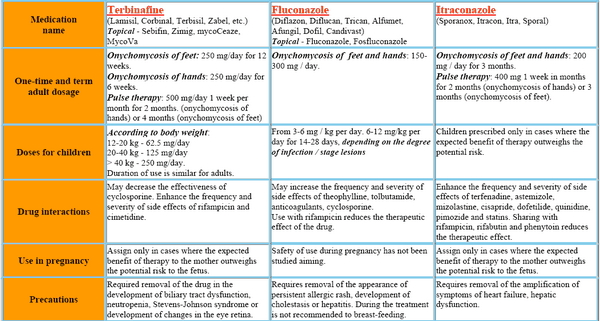
L’itraconazolo può essere utilizzato per il trattamento di varie infezioni fungine superficiali, tra cui le dermatofitosi, la pitiriasi versicolor e le forme mucose e cutanee di candidosi. È anche efficace nei pazienti con infezioni sottocutanee, come cromoblastomicosi, sporotricosi e alcune forme di feofomicosi. È diventato il farmaco di scelta per le forme non pericolose di blastomicosi e istoplasmosi ed è un’alternativa all’amfotericina B per l’aspergillosi invasiva. In Italia, l’itraconazolo è comunemente disponibile con diversi nomi commerciali, tra cui “Sporanox” è uno dei più conosciuti. Altre opzioni possono essere i generici e i marchi regionali che offrono la stessa formulazione.
Nomenclatura del farmaco
Classi terapeutiche di Itraconazolo
Agenti antimicotici, Antimicotici, Agenti antiprotozoari, Antiprotozoi.
Farmacopea Europea, 6a ed. (Itraconazolo)
Polvere bianca o quasi bianca. Praticamente insolubile in acqua, leggermente solubile in alcol, liberamente solubile in diclorometano, scarsamente solubile in tetraidrofurano. Proteggere dalla luce.
L’itraconazolo è stato approvato dall’Agenzia Italiana del Farmaco (AIFA). L’AIFA è responsabile della regolamentazione dell’uso dei farmaci in Italia, della sicurezza e della sorveglianza dei prodotti farmaceutici.
Farmacocinetica
L’assorbimento dell’itraconazolo dal tratto gastrointestinale è incompleto (circa il 55%), ma migliora se il farmaco viene somministrato con il cibo. La somministrazione orale di una singola capsula da 100 mg produce concentrazioni sieriche di picco comprese tra 0,1 e 0,2 mg/l circa 2-4 ore dopo. Concentrazioni più elevate si ottengono dopo somministrazioni ripetute, ma vi è una marcata variazione tra gli individui. Come nel caso del ketoconazolo, si verifica un aumento sproporzionato dei livelli ematici con l’aumento del dosaggio. Le concentrazioni sieriche sono notevolmente ridotte quando la produzione di acido gastrico è compromessa.
Concentrazioni ematiche molto più elevate (fino a 1,0-1,5 mg/1) sono state raggiunte in pazienti con AIDS e in soggetti neutropenici dopo la somministrazione di una dose di 5 mg/kg di itraconazolo in soluzione orale per 1-2 settimane. Questa formulazione viene assorbita meglio se somministrata senza cibo.
Come la maggior parte degli altri antimicotici azolici, il legame proteico dell’itraconazolo è elevato e supera il 99% nel siero umano. Di conseguenza, le concentrazioni del farmaco nei fluidi corporei come il liquor sono minime. Al contrario, le concentrazioni del farmaco nei tessuti, come polmoni, fegato e ossa, sono da due a tre volte superiori a quelle del siero. Elevate concentrazioni di itraconazolo si trovano anche nello strato corneo come risultato della secrezione del farmaco nel sebo. È stato riscontrato che l’itraconazolo persiste nella pelle per 2-4 settimane dopo la fine di un ciclo di trattamento di 4 settimane. Persiste nelle unghie dei piedi fino a 6 mesi dopo la fine di un trattamento di 3 mesi, ma i livelli nelle unghie diminuiscono circa 3 mesi dopo la fine del trattamento.
Meno dello 0,03% di una dose somministrata di itraconazolo viene escreto immutato nelle urine, ma fino al 18% viene eliminato nelle feci come farmaco immutato.
Studi e sperimentazioni cliniche in Italia
L’itraconazolo è stato oggetto di numerosi studi e sperimentazioni cliniche condotti in Italia, con particolare attenzione alla sua efficacia nel trattamento delle infezioni fungine. Questi studi hanno esplorato il suo uso nel trattamento di condizioni come le infezioni fungine delle unghie e le micosi sistemiche. La ricerca ha dimostrato che l’itraconazolo è generalmente efficace, anche se alcuni studi hanno evidenziato i suoi effetti collaterali, come la tossicità epatica, che sono stati attentamente monitorati. I risultati di questi studi hanno contribuito al continuo perfezionamento dei protocolli di trattamento delle infezioni fungine nel sistema sanitario italiano.
Diversi specialisti italiani hanno discusso dell’Itraconazolo, in particolare nel campo della dermatologia e delle malattie infettive. Il dottor Marco Rossi, uno dei maggiori esperti nel trattamento delle dermatofitosi, ha parlato spesso dei benefici e delle sfide dell’Itraconazolo. Anche la dottoressa Anna Bianchi, esperta di malattie infettive, ha contribuito alle discussioni sull’efficacia dell’Itraconazolo nel trattamento delle infezioni fungine sistemiche.
Uso
In Italia l’itraconazolo è un farmaco soggetto a prescrizione medica. Può essere ottenuto solo attraverso la prescrizione del medico, che ne garantisce l’uso appropriato sotto controllo medico.
Le capsule di itraconazolo per via endovenosa e orale sono utilizzate per il trattamento di infezioni fungine sistemiche in pazienti immunocompromessi e immunocompetenti. Queste includono la blastomicosi (polmonare ed extrapolmonare), l’istoplasmosi (compresa la malattia polmonare cavitaria cronica e la malattia disseminata non meningea) e l’aspergillosi (polmonare ed extrapolmonare in pazienti che non rispondono o non tollerano l’amfotericina B).
L’itraconazolo soluzione orale (ma non le capsule di itraconazolo) è utilizzato per il trattamento della candidosi orofaringea ed esofagea. L’itraconazolo (somministrato inizialmente per via endovenosa, seguito da itraconazolo soluzione orale) è utilizzato per la terapia antimicotica empirica nei pazienti neutropenici febbrili. Le capsule orali di itraconazolo sono utilizzate in soggetti immunocompetenti per il trattamento della tinea unguium (onicomicosi) dell’unghia del piede e/o dell’unghia del dito causata da dermatofiti.

L’itraconazolo è utilizzato anche per via orale per la prevenzione di gravi infezioni fungine (ad es. coccidioidomicosi, criptococcosi, istoplasmosi, candidosi mucocutanea) in pazienti con infezione da virus dell’immunodeficienza umana (HIV). Prima di iniziare la terapia con itraconazolo per via endovenosa o capsule di itraconazolo per via orale per il trattamento delle infezioni fungine sistemiche, è necessario ottenere campioni appropriati per la coltura fungina e altri studi di laboratorio pertinenti (wet mount, istopatologia, sierologia) al fine di isolare e identificare l’organismo o gli organismi causali. La terapia con itraconazolo può essere iniziata in attesa dei risultati di questi test in vitro; tuttavia, una volta disponibili i risultati, la terapia deve essere adeguata di conseguenza. Prima di iniziare la terapia con itraconazolo capsule orali per il trattamento dell’onicomicosi, è necessario ottenere campioni ungueali appropriati per studi microbiologici (ad esempio, preparazione di idrossido di potassio [KOH], coltura fungina, biopsia ungueale) per confermare la diagnosi.
Aspergillosi
L’itraconazolo è utilizzato nel trattamento dell’aspergillosi polmonare ed extrapolmonare in pazienti intolleranti o refrattari all’amfotericina B per via endovenosa. L’amfotericina B per via endovenosa è generalmente considerata il trattamento di scelta per l’aspergillosi invasiva, in particolare per le infezioni gravi e pericolose per la vita, e l’itraconazolo è un agente alternativo. In un numero limitato di pazienti con aspergillosi invasiva che non hanno risposto o non hanno potuto tollerare l’amfotericina B per via endovenosa, le capsule di itraconazolo per via orale (200-400 mg al giorno per una durata mediana della terapia di 3-4 mesi) si sono rivelate efficaci come terapia di seconda linea.
Blastomicosi
L’itraconazolo è utilizzato nel trattamento della blastomicosi polmonare ed extrapolmonare causata da Blastomyces dermatitidis. Sebbene sia l’itraconazolo in capsule per via orale che l’amfotericina B per via endovenosa siano considerati farmaci di scelta per il trattamento della blastomicosi, l’amfotericina B è da preferire per il trattamento di infezioni gravi, soprattutto quelle che coinvolgono il sistema nervoso centrale. L’amfotericina B per via endovenosa è generalmente preferita anche per il trattamento iniziale della blastomicosi presunta nei pazienti immunocompromessi, compresi i soggetti con infezione da HIV. Molti medici considerano l’itraconazolo orale il farmaco di scelta per il trattamento della blastomicosi non meningea e non pericolosa per la vita, comprese le infezioni disseminate da lievi a moderate senza coinvolgimento del SNC, e raccomandano il farmaco anche per la terapia di follow-up nei pazienti con infezioni più gravi dopo che è stata ottenuta una risposta iniziale con l’amfotericina B per via endovenosa.
Sono stati segnalati fallimenti del trattamento quando un agente antimicotico orale (per esempio, il ketoconazolo) è stato usato per trattare la blastomicosi cutanea o polmonare in pazienti che avevano un coinvolgimento asintomatico o subclinico del SNC al momento della diagnosi iniziale. Questo aspetto deve essere preso in considerazione quando si sceglie un agente antimicotico per i pazienti affetti da blastomicosi. Alcuni medici affermano che gli antimicotici azolici non dovrebbero essere utilizzati per il trattamento primario dei pazienti con blastomicosi del SNC.
Istoplasmosi
L’itraconazolo è utilizzato nel trattamento dell’istoplasmosi, compresa la malattia polmonare cavitaria cronica e la malattia disseminata non meningea. Sia l’amfotericina B per via endovenosa che le capsule di itraconazolo per via orale sono considerate farmaci di scelta per il trattamento dell’istoplasmosi. Tuttavia, l’amfotericina B per via endovenosa è generalmente preferita per il trattamento iniziale dell’istoplasmosi grave e pericolosa per la vita, soprattutto nei pazienti immunocompromessi come quelli con infezione da HIV.
L’itraconazolo orale è generalmente utilizzato nel trattamento iniziale di infezioni da lievi a moderate (per esempio, in pazienti che non richiedono l’ospedalizzazione) o come terapia di follow-up nel trattamento di infezioni gravi dopo che è stata ottenuta una risposta con l’amfotericina B. L’itraconazolo è stato utilizzato per il trattamento dell’istoplasmosi disseminata in pazienti con infezione da HIV.
Il produttore afferma che i dati relativi a un numero limitato di pazienti indicano che il tasso di risposta dell’istoplasmosi alla terapia con itraconazolo nei soggetti infetti da HIV è simile a quello dei pazienti non infetti da questo virus. Tuttavia, il decorso clinico dell’istoplasmosi nei soggetti con infezione da HIV è generalmente più grave e di solito richiede una terapia di mantenimento a lungo termine per prevenire le ricadute. Sono in corso studi per stabilire ulteriormente la sicurezza e l’efficacia del farmaco nel trattamento di questa infezione nei soggetti con infezione da HIV, compresa l’indagine sul dosaggio ottimale e sulla durata della terapia di mantenimento. L’itraconazolo orale è considerato il farmaco di scelta per la profilassi primaria e la terapia soppressiva o di mantenimento a lungo termine (profilassi secondaria) per prevenire le recidive o le ricadute dell’istoplasmosi nei soggetti con infezione da HIV. (Vedi Usi: Prevenzione delle infezioni fungine nei soggetti con infezione da HIV)
Candidiasi orofaringea ed esofagea
Poiché gli effetti topici e l’esposizione al farmaco possono essere maggiori con la soluzione orale che con le capsule di itraconazolo, solo l’itraconazolo soluzione orale deve essere usato per il trattamento della candidosi orofaringea ed esofagea. In 2 studi controllati condotti su pazienti affetti da candidosi orofaringea (il 92% dei quali era affetto da HIV), è stata ottenuta una risposta clinica (definita come guarigione o miglioramento) nel 71-84% dei pazienti che hanno ricevuto itraconazolo soluzione orale. Esistono prove che l’itraconazolo soluzione orale sia efficace almeno quanto le compresse di fluconazolo per via orale e possa essere più efficace delle pastiglie di clotrimazolo per via orale per il trattamento della candidosi orofaringea. L’itraconazolo soluzione orale si è rivelato efficace per il trattamento della candidosi orofaringea in alcuni pazienti, compresi alcuni soggetti con infezione da HIV, che non hanno risposto al fluconazolo orale.
Sporotricosi
Questo farmaco è usato per trattare la sporotricosi. Mentre l’itraconazolo orale può essere efficace nei pazienti con sporotricosi polmonare o disseminata da lieve a moderata, l’amfotericina B per via endovenosa è il farmaco di scelta per il trattamento iniziale di infezioni gravi e pericolose per la vita e in caso di coinvolgimento del SNC. L’itraconazolo orale è generalmente considerato il farmaco di scelta per il trattamento della sporotricosi cutanea, linfocutanea o lievemente polmonare o osteoarticolare e per la terapia di follow-up nelle infezioni più gravi dopo aver ottenuto una risposta con l’amfotericina B per via endovenosa.
Poiché la sporotricosi in pazienti immunocompromessi (per esempio, individui con infezione da HIV) è particolarmente aggressiva e difficile da trattare, l’amfotericina B per via endovenosa è probabilmente il farmaco di scelta per la terapia iniziale in questi pazienti; tuttavia, si verificano fallimenti del trattamento. Alcuni medici raccomandano che i soggetti con infezione da HIV trattati per la sporotricosi ricevano itraconazolo orale per la terapia soppressiva o di mantenimento per tutta la vita per prevenire le ricadute; tale profilassi non è trattata nelle attuali linee guida dell’US Public Health Service e dell’Infectious Diseases Society of America (USPHS/IDSA) per la prevenzione delle infezioni opportunistiche nei soggetti con infezione da HIV.
Onicomicosi
Le capsule di itraconazolo per via orale sono utilizzate in soggetti immunocompetenti per il trattamento dell’onicomicosi delle unghie dei piedi (con o senza coinvolgimento delle unghie) e dell’onicomicosi delle unghie causata da dermatofiti (tinea unguium).
Prima di somministrare le capsule di itraconazolo per il trattamento dell’onicomicosi, è necessario ottenere campioni di unghie appropriati per studi microbiologici (ad esempio, preparazione di idrossido di potassio [KOH], coltura fungina, biopsia ungueale) per confermare la diagnosi. In studi in doppio cieco, controllati con placebo, condotti su pazienti affetti da onicomicosi delle unghie dei piedi, l’itraconazolo orale (200 mg in capsule somministrate una volta al giorno per 12 settimane consecutive) ha portato a una guarigione micologica nel 54% dei pazienti; il 35% è stato considerato un successo globale (guarigione micologica e coinvolgimento ungueale chiaro o minimo con segni significativamente ridotti) e il 14% ha avuto una guarigione micologica più una guarigione clinica (eliminazione di tutti i segni, con o senza deformità ungueale residua).
Il tempo medio per il successo complessivo è stato di circa 10 mesi; tuttavia, il 21% dei soggetti considerati un successo complessivo ha avuto una ricaduta dell’onicomicosi. In uno studio in doppio cieco, controllato con placebo, condotto su pazienti affetti da onicomicosi delle unghie, l’itraconazolo orale somministrato con un regime di dosaggio a impulsi (200 mg in capsule due volte al giorno per la prima settimana, nessun itraconazolo durante le settimane 2-4 e 200 mg in capsule due volte al giorno durante la quinta settimana) ha portato a una guarigione micologica nel 61% dei pazienti; il 56% è stato considerato un successo globale e il 47% ha avuto una guarigione micologica più una guarigione clinica. Il tempo medio per il successo globale è stato di circa 5 mesi; non ci sono state ricadute in coloro che sono stati considerati un successo globale.
Paracoccidioidomicosi
Le capsule di itraconazolo per via orale sono utilizzate nel trattamento della paracoccidioidomicosi (blastomicosi sudamericana) causata da Paracoccidioides brasiliensis e sono considerate un farmaco di scelta per il trattamento di questa infezione. Sebbene non sia stato identificato il regime più efficace per il trattamento della paracoccidioidomicosi nei soggetti con infezione da HIV, alcuni medici suggeriscono che questi pazienti ricevano una terapia iniziale con amfotericina B per via endovenosa e che un agente meno tossico (ad es, capsule orali di itraconazolo, co-trimoxazolo) può essere utilizzato per la terapia soppressiva a lungo termine per la profilassi contro le recidive; tale profilassi non è trattata nelle attuali linee guida raccomandate dall’USPHS/IDSA per la prevenzione delle infezioni opportunistiche nei soggetti con infezione da HIV.
Coccidioidomicosi e criptococcosi
Sebbene non sia considerato un farmaco di prima scelta, le capsule orali di itraconazolo sono utilizzate come agente alternativo per il trattamento della coccidioidomicosi o della criptococcosi. Le capsule di itraconazolo sono utilizzate anche come agente alternativo per la profilassi primaria della criptococcosi o per la terapia soppressiva o di mantenimento per prevenire la recidiva o la ricaduta della coccidioidomicosi o della criptococcosi nei soggetti infetti da HIV.
Cromomicosi
Le capsule di itraconazolo per via orale sono state utilizzate con un certo successo per il trattamento della cromomicosi (cromoblastomicosi) causata da vari funghi dematiacei (ad esempio, Cladosporium, Exophiala, Fonsecaea, Phialophora).
Basidiobolomicosi
L’itraconazolo orale è stato utilizzato in un numero limitato di pazienti per trattare la basidiobolomicosi gastrointestinale, una zigomicosi causata da Basidiobolus ranarum. B. ranarum è stato isolato in tutto il mondo da vegetazione e suolo in decomposizione e dal tratto gastrointestinale di rettili, anfibi, pesci e pipistrelli insettivori (anche negli Stati Uniti). La basidiobolomicosi si verifica più comunemente nelle regioni tropicali e subtropicali, come l’Africa orientale e occidentale, e l’infezione si manifesta di solito con noduli sottocutanei indolori agli arti, al tronco o ai glutei, secondari a inoculazione traumatica.
Le infezioni gastrointestinali sono estremamente rare e possono essere il risultato dell’ingestione di terreno contaminato (soprattutto in prossimità di fiumi o laghi) o di frutta o verdura contaminata da terreno o feci di rettili o anfibi infetti. Dall’aprile 1994 al maggio 1999, in Arizona sono stati identificati 7 casi di basidiobolomicosi gastrointestinale. La maggior parte dei casi di basidiobolomicosi gastrointestinale è stata trattata con successo con itraconazolo orale (400 mg al giorno per 3-19 mesi) dopo resezione chirurgica parziale del tratto gastrointestinale; tuttavia, non è chiaro se si sarebbe ottenuta una risposta clinica se l’itraconazolo fosse stato usato da solo senza intervento chirurgico. Sebbene anche il ketoconazolo sia stato riportato come efficace in almeno un paziente, l’amfotericina B si è rivelata inefficace per il trattamento della basidiobolomicosi gastrointestinale in diversi pazienti.
Terapia empirica nei pazienti neutropenici febbrili
L’itraconazolo (somministrato inizialmente per via endovenosa, seguito da una soluzione orale di itraconazolo) è utilizzato per la terapia empirica di presunte infezioni fungine in pazienti neutropenici febbrili. La sicurezza e l’efficacia dell’itraconazolo per questa indicazione sono state valutate in uno studio aperto e randomizzato su adulti neutropenici febbrili con neoplasie ematologiche; i pazienti hanno ricevuto o l’itraconazolo (200 mg per via endovenosa due volte al giorno per 2 giorni, poi 200 mg per via endovenosa una volta al giorno dai giorni 3 ai 14 seguiti da itraconazolo soluzione orale 200 mg due volte al giorno per completare fino a 28 giorni di terapia) o l’amfotericina B convenzionale per via endovenosa (0,7-1 mg/kg al giorno per un massimo di 28 giorni). Il tasso di successo terapeutico (definito come sopravvivenza del paziente con risoluzione della febbre e della neutropenia entro 28 giorni di terapia, assenza di infezioni fungine emergenti, uso del farmaco in studio senza interruzione prematura per tossicità o mancanza di efficacia e terapia per 3 o più giorni) è stato del 47% per l’itraconazolo e del 38% per l’amfotericina B (analisi intent-to-treat). Sebbene il tasso di risposta complessivo fosse più alto nei pazienti che ricevevano itraconazolo, un numero maggiore di pazienti che ricevevano itraconazolo interrompeva il farmaco a causa della febbre persistente o cambiava la terapia antimicotica a causa della febbre e un numero maggiore di pazienti che ricevevano amfotericina B interrompeva il farmaco a causa dell’intolleranza.
Prevenzione delle infezioni fungine nei soggetti infettati dall’HIV
L’itraconazolo orale è utilizzato in pazienti selezionati con infezione da HIV per la profilassi primaria contro la criptococcosi o l’istoplasmosi e per la terapia soppressiva o di mantenimento a lungo termine (profilassi secondaria) per prevenire le recidive di coccidioidomicosi, criptococcosi, istoplasmosi o candidosi mucocutanea.
Il gruppo di lavoro sulla prevenzione delle infezioni opportunistiche dell’USPHS/IDSA ha stabilito delle linee guida per la prevenzione delle infezioni opportunistiche, comprese le infezioni fungine, nei soggetti con infezione da HIV. Queste linee guida includono raccomandazioni relative alla prevenzione dell’esposizione a patogeni opportunistici, alla prevenzione dei primi episodi di malattia e alla prevenzione delle recidive. L’USPHS/IDSA afferma che la profilassi primaria per prevenire i primi episodi di candidosi mucocutanea in adulti, adolescenti, neonati e bambini con infezione da HIV non è raccomandata.
Mentre la profilassi primaria di routine per prevenire i primi episodi di coccidioidomicosi, criptococcosi o istoplasmosi in adulti, adolescenti, neonati e bambini con infezione da HIV non è raccomandata, l’USPHS/IDSA afferma che la profilassi primaria contro la criptococcosi o l’istoplasmosi può essere presa in considerazione in alcuni individui selezionati. L’USPHS/IDSA raccomanda che gli adulti, gli adolescenti, i neonati e i bambini con infezione da HIV che hanno completato la terapia iniziale per coccidioidomicosi, criptococcosi o istoplasmosi documentate ricevano una terapia soppressiva o di mantenimento a lungo termine (profilassi secondaria) per prevenire le recidive di queste infezioni fungine.
Inoltre, l’USPHS/IDSA afferma che i soggetti con infezione da HIV che presentano frequenti o gravi recidive di candidosi mucocutanea possono beneficiare di una terapia soppressiva o di mantenimento a lungo termine (profilassi secondaria). A causa delle preoccupazioni relative all’uso di agenti antimicotici azolici orali durante la gravidanza, l’itraconazolo non deve essere usato per la profilassi primaria o per la terapia cronica soppressiva o di mantenimento nelle donne in gravidanza. Se una donna rimane incinta mentre riceve itraconazolo per la profilassi e decide di continuare la gravidanza, il farmaco deve essere interrotto.
Misure contraccettive efficaci sono raccomandate per tutte le donne con infezione da HIV che ricevono un agente antimicotico azolico orale per la terapia di soppressione. L’amfotericina B convenzionale per via endovenosa può essere l’agente preferito se è indicata una terapia soppressiva o di mantenimento a lungo termine contro coccidioidomicosi, criptococcosi o istoplasmosi in una donna gravida con infezione da HIV, soprattutto durante il primo trimestre.
Profilassi primaria
La sicurezza e l’efficacia dell’itraconazolo orale per la profilassi primaria delle infezioni fungine gravi nei soggetti con infezione da HIV sono state valutate in uno studio prospettico, randomizzato, controllato con placebo su 149 pazienti con infezione da HIV avanzata. La profilassi è fallita nel 19% dei pazienti che hanno ricevuto itraconazolo orale (200 mg una volta al giorno) e nel 29% di quelli che hanno ricevuto placebo. I fallimenti della profilassi legati a infezioni fungine invasive (istoplasmosi, criptococcosi, aspergillosi) sono stati più frequenti nei pazienti che hanno ricevuto il placebo rispetto a quelli che hanno ricevuto l’itraconazolo; tuttavia, l’incidenza di fallimenti della profilassi dovuti a candidosi mucosale ricorrente o refrattaria è stata simile nei due gruppi. Sebbene la profilassi con itraconazolo abbia ritardato significativamente il tempo di insorgenza dell’istoplasmosi e della criptococcosi, non è stato dimostrato un beneficio in termini di sopravvivenza nei soggetti che hanno ricevuto il farmaco.
Criptococcosi
L’USPHS/IDSA afferma che, sebbene la profilassi primaria di routine contro la criptococcosi non sia raccomandata, la profilassi primaria può essere presa in considerazione negli adulti e negli adolescenti con infezione da HIV e conta delle cellule T4 inferiore a 50/mm3 e nei neonati e nei bambini con grave immunosoppressione (come definito dai criteri aggiustati per età). La profilassi di routine non è raccomandata a causa della relativa infrequenza della malattia criptococcica, della mancanza di prove di un beneficio in termini di sopravvivenza associato alla profilassi e di altre preoccupazioni (ad esempio, possibilità di interazioni farmacologiche, potenziale sviluppo di resistenza, considerazioni sui costi).
La necessità di una profilassi primaria o di una terapia soppressiva contro altre infezioni fungine (per esempio, coccidioidomicosi, istoplasmosi, candidosi mucocutanea) deve essere presa in considerazione durante la decisione sulla profilassi della criptococcosi. L’analisi di routine di individui asintomatici per l’antigene criptococcico nel siero non è raccomandata a causa della bassa probabilità che i risultati influenzino le decisioni cliniche. I soggetti con infezione da HIV non possono evitare completamente l’esposizione al Cryptococcus neoformans; non ci sono prove che l’esposizione agli escrementi di piccione sia associata a un aumento del rischio di criptococcosi. Il fluconazolo orale è l’agente di scelta per la profilassi primaria contro la criptococcosi negli adulti, adolescenti, neonati e bambini con infezione da HIV; l’itraconazolo orale (somministrato sotto forma di capsule) è considerato un’alternativa.
Istoplasmosi
L’USPHS/IDSA afferma che la profilassi primaria contro l’istoplasmosi può essere presa in considerazione negli adulti o negli adolescenti infettati dall’HIV con conta assoluta delle cellule T helper/inducer (CD4 , T4 ) inferiore a 100/mm3 che sono a rischio particolarmente elevato di esposizione a Histoplasma capsulatum a causa dell’esposizione professionale o che vivono in una comunità con un tasso iperendemico di istoplasmosi (almeno 10 casi/100 anni-paziente) e può essere presa in considerazione anche per i neonati o i bambini con infezione da HIV e grave immunosoppressione (secondo i criteri aggiustati per età) che vivono in aree endemiche per l’istoplasmosi.
Nel decidere se utilizzare la profilassi primaria contro l’istoplasmosi in questi soggetti con infezione da HIV, i medici devono considerare l’incidenza locale dell’istoplasmosi, la possibilità di interazioni farmacologiche, la tossicità, lo sviluppo di resistenze, il costo e la necessità di una profilassi contro altre infezioni fungine (ad esempio, candidiasi, criptococcosi).
Il test cutaneo di routine con istoplasmina o il test sierologico per gli anticorpi o gli antigeni dell’istoplasmosi nei soggetti con infezione da HIV che vivono in aree endemiche per l’istoplasmosi non è predittivo di malattia e non è raccomandato. Sebbene i soggetti con infezione da HIV che vivono o visitano aree endemiche per l’istoplasmosi non possano evitare completamente l’esposizione a H. capsulatum, coloro che hanno una conta dei linfociti T4 inferiore a 200/mm3 dovrebbero evitare le attività notoriamente associate a un rischio maggiore (per esempio, la creazione di polvere lavorando con il terreno in superficie; la pulizia di pollai fortemente contaminati da escrementi; il disturbo del terreno al di sotto di siti in cui si posano gli uccelli; la pulizia, la ristrutturazione o la demolizione di vecchi edifici; l’esplorazione di grotte). L’itraconazolo orale (somministrato sotto forma di capsule) è l’agente di scelta per la profilassi primaria contro l’istoplasmosi negli adulti, negli adolescenti e nei pazienti pediatrici con infezione da HIV; l’USPHS/IDSA non raccomanda alcuna alternativa all’itraconazolo.
Prevenzione delle recidive
Coccidioidomicosi: Per la terapia soppressiva o di mantenimento a lungo termine (profilassi secondaria) per prevenire recidive o ricadute in adulti, adolescenti, neonati e bambini con coccidioidomicosi documentata e adeguatamente trattata, l’USPHS/IDSA raccomanda il fluconazolo orale come farmaco di scelta e l’amfotericina B per via endovenosa o l’itraconazolo orale (somministrato in capsule) come alternative. La terapia soppressiva o di mantenimento a lungo termine per la profilassi contro le recidive di coccidioidomicosi nei soggetti con infezione da HIV viene generalmente proseguita per tutta la vita. Sebbene i soggetti con infezione da HIV che ricevono una profilassi antimicotica soppressiva contro la coccidioidomicosi possano essere a basso rischio di recidiva di questa infezione fungina se la loro conta delle cellule T4 aumenta a più di 100/mm3 mentre ricevono una potente terapia di combinazione di agenti antiretrovirali, l’USPHS/IDSA afferma che i dati sono insufficienti per giustificare una raccomandazione sull’interruzione della profilassi in questi soggetti.
Criptococcosi: Per la terapia soppressiva o di mantenimento a lungo termine (profilassi secondaria) per prevenire recidive o ricadute in adulti, adolescenti, neonati e bambini con criptococcosi documentata e adeguatamente trattata, l’USPHS/IDSA raccomanda il fluconazolo orale come farmaco di scelta e l’amfotericina B per via endovenosa o l’itraconazolo orale (in capsule) come alternative.
La terapia soppressiva o di mantenimento (profilassi secondaria) per prevenire la recidiva o la ricaduta della criptococcosi nei soggetti infetti da HIV viene generalmente proseguita per tutta la vita, a meno che non si sia verificato un recupero immunitario a seguito di una potente terapia antiretrovirale.
Istoplasmosi: Per la terapia soppressiva o di mantenimento a lungo termine per prevenire recidive o ricadute in adulti, adolescenti, neonati e bambini con istoplasmosi documentata che è stata adeguatamente trattata, l’USPHS/IDSA raccomanda l’itraconazolo orale (somministrato sotto forma di capsule) come farmaco di scelta e l’amfotericina B per via endovenosa come alternativa. La terapia soppressiva o di mantenimento a lungo termine contro l’istoplasmosi nei soggetti con infezione da HIV viene generalmente proseguita per tutta la vita. Sebbene i pazienti che ricevono una profilassi antimicotica soppressiva possano essere a basso rischio di recidiva di istoplasmosi se la loro conta delle cellule T4 aumenta a più di 100/mm3 mentre ricevono una potente terapia di combinazione di agenti antiretrovirali, l’USPHS/IDSA afferma che i dati sono insufficienti per giustificare una raccomandazione sull’interruzione della profilassi in questi soggetti.
Candidiasi mucocutanea: L’USPHS/IDSA raccomanda una terapia soppressiva o di mantenimento a lungo termine per gli adulti e gli adolescenti con una storia documentata di candidosi esofagea (soprattutto in caso di episodi multipli), considerando il potenziale sviluppo di ceppi resistenti di Candida. Inoltre, l’USPHS/IDSA raccomanda la terapia soppressiva per i neonati e i bambini con candidosi mucocutanea grave e ricorrente, in particolare quelli con candidosi esofagea.
Sebbene molti esperti non raccomandino una terapia soppressiva a lungo termine per le candidosi orofaringee o vulvovaginali ricorrenti, per le stesse ragioni non raccomandano la profilassi primaria contro la candidosi. L’USPHS/IDSA afferma che la terapia soppressiva contro la candidosi può essere presa in considerazione nei soggetti con infezione da HIV con frequenti o gravi recidive di queste infezioni.
Tuttavia, quando si prende in considerazione tale terapia, si devono considerare diversi fattori, tra cui l’impatto delle recidive sul benessere e sulla qualità di vita del paziente, la necessità di una profilassi contro altre infezioni fungine, il costo della profilassi, le tossicità dei farmaci, le interazioni farmacologiche e il potenziale sviluppo di resistenza ai farmaci tra Candida e altri funghi. Se è indicata una terapia soppressiva o di mantenimento a lungo termine in adulti, adolescenti, neonati o bambini con infezione da HIV e recidive frequenti o gravi di candidosi orofaringea, esofagea o vaginale, l’USPHS/IDSA raccomanda il fluconazolo orale come farmaco di scelta e l’itraconazolo (somministrato come soluzione orale) come alternativa.
Somministrazione
L’itraconazolo viene somministrato per via orale o per infusione endovenosa.
In Italia l’itraconazolo è disponibile in diverse forme, tra cui capsule, soluzione orale e formulazioni per via endovenosa. I dosaggi più comuni sono capsule da 100 mg e 200 mg, mentre la soluzione orale è disponibile nella dose di 10 mg/mL.
Somministrazione orale
La biodisponibilità dell’itraconazolo per via orale varia a seconda che il farmaco sia somministrato sotto forma di capsule o di soluzione orale, e il produttore dichiara che queste preparazioni non devono essere utilizzate in modo intercambiabile. L’itraconazolo soluzione orale (non le capsule di itraconazolo) è indicato per il trattamento della candidosi orofaringea o esofagea. Mentre l’itraconazolo soluzione orale deve essere somministrato possibilmente senza cibo, l’itraconazolo capsule deve essere somministrato con un pasto completo per garantire il massimo assorbimento del farmaco. Si deve considerare la possibilità che l’assorbimento gastrointestinale del farmaco possa essere ridotto nei pazienti con ipocloridria, che è stata segnalata nei soggetti infetti da HIV.
Infusione endovenosa
L’itraconazolo iniettabile disponibile in commercio deve essere diluito prima dell’infusione endovenosa. L’intero contenuto di una fiala contenente itraconazolo iniettabile (250 mg) deve essere aggiunto al diluente per iniezione di cloruro di sodio allo 0,9% (50 mL) fornito dal produttore per ottenere una soluzione contenente 3,33 mg/mL in un volume risultante di 75 mL.
Per garantire la massima sicurezza ed efficacia, la soluzione di itraconazolo deve essere preparata e somministrata correttamente. È necessario utilizzare il rapporto appropriato tra itraconazolo e diluente e mantenere una concentrazione finale di 3,33 mg/mL per fornire una miscela stabile ed evitare la formazione di un precipitato.
Quando la soluzione e il contenitore lo consentono, l’iniezione di Itraconazolo e le soluzioni diluite del farmaco devono essere ispezionate visivamente per verificare la presenza di particelle e di scolorimento prima della somministrazione. Per fornire una dose da 200 mg di itraconazolo, la soluzione diluita deve essere mescolata delicatamente, quindi 15 ml devono essere prelevati e scartati. I restanti 60 mL di soluzione diluita contenente 3,33 mg/mL devono essere somministrati per infusione endovenosa nell’arco di 60 minuti.
L’infusione deve essere effettuata utilizzando un dispositivo di infusione controllata, il set di infusione fornito dal produttore e una linea IV dedicata. L’itraconazolo non deve essere mescolato con altri farmaci e non deve essere somministrato attraverso la stessa linea IV di altri farmaci. Al termine dell’infusione, il produttore raccomanda di lavare il set di infusione attraverso il rubinetto a 2 vie con 15-20 mL di cloruro di sodio allo 0,9% iniettati in un tempo compreso tra 30 secondi e 15 minuti; l’intera linea endovenosa deve quindi essere eliminata. La soluzione batteriostatica di cloruro di sodio non deve essere utilizzata come soluzione di lavaggio, poiché non è nota la compatibilità della soluzione di itraconazolo con soluzioni di lavaggio diverse dal cloruro di sodio allo 0,9%.
Dosaggio
A causa delle differenze nella biodisponibilità orale, le capsule di itraconazolo e la soluzione orale non devono essere utilizzate in modo intercambiabile su base mg per mg.
Il dosaggio delle capsule di itraconazolo deve essere basato sul tipo e sulla gravità dell’infezione, sull’identità dell’organismo causale e sulla risposta del paziente alla terapia. Il farmaco sembra subire un metabolismo saturabile nel fegato; pertanto, l’aumento del dosaggio può comportare un aumento più che proporzionale delle concentrazioni plasmatiche.
Per il trattamento di infezioni fungine sistemiche pericolose per la vita, l’itraconazolo per via endovenosa o le capsule di itraconazolo per via orale devono essere iniziate con un dosaggio di carico. Se si utilizza inizialmente l’itraconazolo per via endovenosa, il dosaggio di carico raccomandato negli adulti è di 200 mg per via endovenosa due volte al giorno per 4 dosi consecutive, seguite successivamente da 200 mg una volta al giorno.
Sebbene gli studi clinici che hanno valutato la sicurezza e l’efficacia delle capsule orali di itraconazolo non includano un dosaggio di carico, sulla base di considerazioni farmacocinetiche, il produttore e alcuni medici affermano che le capsule orali di itraconazolo dovrebbero essere iniziate nelle infezioni pericolose per la vita negli adulti utilizzando una dose iniziale di carico di 200 mg tre volte al giorno (600 mg al giorno) per i primi tre o quattro giorni di terapia. La terapia successiva può essere proseguita alla dose orale abituale di 200-400 mg al giorno.
Il produttore afferma che la terapia con itraconazolo deve essere continuata per almeno tre mesi fino a quando i parametri clinici e gli esami di laboratorio indicano che l’infezione fungina attiva si è attenuata. Alcuni medici affermano che, sebbene la durata ottimale della terapia per le infezioni fungine gravi non sia stata stabilita, la terapia con itraconazolo dovrebbe probabilmente essere continuata per almeno 12 mesi per l’istoplasmosi polmonare disseminata o cronica e per 6-12 mesi per la blastomicosi. Un periodo di trattamento inadeguato può provocare una recidiva dell’infezione attiva.
| Condizioni | Dosaggio | Via di somministrazione | Durata |
|---|---|---|---|
| Aspergillosi polmonare ed extrapolmonare | 200-400 mg al giorno; dosi più elevate (fino a 600 mg) possono essere utilizzate per i casi invasivi | Orale/IV | Per via endovenosa: 200 mg due volte al giorno per 4 dosi, poi 200 mg una volta al giorno; per via orale: secondo necessità |
| Blastomicosi/istoplasmosi | Inizialmente: 200 mg una volta al giorno; aumentare con incrementi di 100 mg fino a un massimo di 400 mg al giorno | Orale/IV | Almeno 6 mesi per la blastomicosi; 12-24 mesi per l’istoplasmosi cronica |
| Candidiasi orofaringea | 100 mg/die per pazienti non compromessi; 200-400 mg/die per pazienti neutropenici | Soluzione orale | Minimo 3 settimane |
| Candidiasi esofagea | 100 mg (10 mL) al giorno, può aumentare a 200 mg (20 mL) al giorno a seconda della risposta | Soluzione orale | Minimo 3 settimane |
| Candidosi vaginale | Due dosi di 200 mg prese a distanza di 6-8 ore l’una dall’altra | Orale | Trattamento di un solo giorno |
| Sporotricosi | 100-200 mg una volta al giorno per le infezioni cutanee; 200 mg due volte al giorno per quelle osteoarticolari | Orale | 3-6 mesi per le cutanee; 12 mesi per le osteoarticolari |
| Onicomicosi | 200 mg una volta al giorno per le unghie dei piedi (12 settimane); dosaggio a impulsi di 400 mg una volta al giorno per una settimana ogni mese per 3 mesi | Orale | Varia a seconda del regime |
| Terapia empirica in pazienti febbrili neutropenici | IV: 200 mg due volte al giorno per 4 dosi, poi diminuire a 200 mg una volta al giorno; orale: 200 mg (20 mL) due volte al giorno fino alla guarigione | IV/Orale | Fino a 14 giorni per via endovenosa, poi per via orale fino alla guarigione |
| Dermatofitosi cutanee | 100 mg/giorno | Per via orale | Tinea corporis/cruris: 2 settimane; Tinea pedis/manuum: 4 settimane |
| Pitiriasi Versicolor | 200 mg/giorno | Orale | 1 settimana |
| Infezione fungina sottocutanea/profonda | 200-400 mg/die; dosi di carico fino a 600 mg/die possono essere utilizzate per le infezioni pericolose per la vita | Per via orale | In corso, secondo le necessità |
| Terapia di mantenimento a lungo termine nei pazienti con AIDS | Istoplasmosi/Criptococcosi: 200 mg/die; pazienti neutropenici: 400 mg/die | Per via orale |
Generalmente continuata per tutta la vita
|
Prevenzione delle infezioni fungine nei soggetti con infezione da HIV
| Condizione | Dosaggio | Via di somministrazione | Durata |
|---|---|---|---|
| Profilassi primaria contro la criptococcosi | Adulti/Adolescenti: 200 mg una volta al giorno; neonati/bambini: 2-5 mg/kg ogni 12-24 ore | Per via orale | In corso, secondo necessità |
| Profilassi primaria contro l’istoplasmosi | Adulti/Adolescenti: 200 mg una volta al giorno; Neonati/Bambini: 2-5 mg/kg ogni 12-24 ore | Per via orale | In corso secondo necessità |
| Profilassi secondaria per la coccidioidomicosi | Adulti/Adolescenti: 200 mg due volte al giorno; neonati/bambini: 2-5 mg/kg ogni 12-48 ore | Per via orale | Generalmente continuata per tutta la vita |
| Profilassi secondaria per l’istoplasmosi | Adulti/Adolescenti: 200 mg due volte al giorno; Neonati/Bambini: 2-5 mg/kg ogni 12-48 ore | Per via orale | Generalmente continua per tutta la vita |
| Profilassi secondaria per la criptococcosi | Adulti/Adolescenti: 200 mg una volta al giorno; Neonati/Bambini: 2-5 mg/kg ogni 12-24 ore | Per via orale | Generalmente continuata per tutta la vita |
| Profilassi secondaria per le candidosi mucocutanee | Adulti/Adolescenti: 200 mg una volta al giorno; Neonati/Bambini: 5 mg/kg una volta al giorno | Soluzione orale | Generalmente continuata per tutta la vita |
Dosaggio nella compromissione renale ed epatica
Non sembra necessario modificare il dosaggio dell’itraconazolo orale nei pazienti con insufficienza renale. L’itraconazolo per via iniettiva non deve essere somministrato a pazienti con compromissione renale (cioè con una clearance della creatinina inferiore a 30 ml/minuto), poiché una grave compromissione renale riduce la clearance dell’idrossipropil-b-ciclodestrina (un eccipiente dell’itraconazolo per via iniettiva).
Sebbene l’effetto della compromissione epatica sulla farmacocinetica dell’itraconazolo non sia ancora stato chiarito, il produttore afferma che le concentrazioni plasmatiche del farmaco devono essere monitorate attentamente nei pazienti con tale compromissione.
Nel Regno Unito, l’itraconazolo liquido orale è autorizzato per l’uso nella candidosi orale ed esofagea alla dose di 200 mg al giorno per una settimana. Può essere assunto in un’unica dose giornaliera o, preferibilmente, in due dosi divise, facendo rimanere il liquido in bocca per 20 secondi prima di deglutire. Se non c’è risposta dopo una settimana, il trattamento può essere continuato per un’altra settimana.
Negli Stati Uniti, un regime simile è autorizzato per la candidosi orofaringea, ma per la candidosi esofagea è preferibile un regime alternativo di 100 mg al giorno per almeno tre settimane, anche se la dose può essere aumentata a 200 mg al giorno se necessario.
Alcune autorità negli Stati Uniti, come i Centers for Disease Control and Prevention, raccomandano dosi più elevate. L’itraconazolo può essere somministrato anche per infusione endovenosa alla dose di 200 mg due volte al giorno nell’arco di un’ora per due giorni, poi 200 mg al giorno.
Dosi elevate
Dosi di itraconazolo di 600 mg al giorno in due dosi divise per 3-16 mesi sono state utilizzate in 8 pazienti con micosi sistemiche resistenti alla terapia convenzionale. Due pazienti con AIDS e meningite criptococcica non hanno risposto, e due che hanno risposto inizialmente hanno poi avuto una ricaduta o hanno sviluppato una malattia progressiva quando la dose è stata ridotta. I principali effetti avversi sono stati ipokaliemia, ipertensione ed edema, probabilmente associati alla soppressione surrenalica. In un paziente con aspergillosi cerebrale, l’itraconazolo 800 mg al giorno per 5 mesi e poi 400 mg al giorno per altri 4 mesi ha prodotto una completa risoluzione delle lesioni cerebrali.
Somministrazione nei bambini
| Indicazione | Gruppo di età | Dosaggio | Durata |
|---|---|---|---|
| Tinea Capitis | Bambini < 20 kg | 50 mg al giorno per bocca | Come prescritto |
| Bambini ≥ 20 kg | 100 mg al giorno per bocca | Come prescritto | |
| Candidiasi orofaringea | da 1 mese a 12 anni | da 3 a 5 mg/kg (max 100 mg) al giorno | 15 giorni |
| da 12 a 18 anni | 100 mg (200 mg in caso di neutropenia o AIDS) al giorno | 15 giorni | |
| Infezioni da dermatofiti | da 1 mese a 12 anni | da 3 a 5 mg/kg al giorno (max 200 mg per pitiriasi versicolor, max 100 mg per tinea corporis, cruris, pedis, manuum) | Varia (7-30 giorni, a seconda del tipo di infezione) |
| da 12 a 18 anni | 200 mg al giorno per la pitiriasi versicolor; 100 mg al giorno per la tinea corporis e cruris; 100 mg al giorno o 200 mg due volte al giorno per la tinea pedis e manuum | Varia (7-30 giorni, a seconda del tipo di infezione) | |
| Onicomicosi | da 1 a 12 anni | Cicli di 5 mg/kg al giorno per unghie (2 cicli) e unghie dei piedi (3 cicli) | Ripetuti a intervalli di 21 giorni |
| da 12 a 18 anni | 200 mg al giorno per 3 mesi o cicli di 200 mg due volte al giorno per le unghie delle mani (2 cicli) e dei piedi (3 cicli) | Ripetuti a intervalli di 21 giorni | |
| Istoplasmosi/Infezioni fungine sistemiche | da 1 mese a 18 anni | 5 mg/kg (max 200 mg) una o due volte al giorno | Come prescritto; due volte al giorno per la malattia invasiva |
| Profilassi della neutropenia | da 1 mese a 18 anni | 5 mg/kg (max 200 mg) al giorno, aumentati a due volte al giorno se le concentrazioni plasmatiche di itraconazolo sono basse | Come prescritto |
| Profilassi nelle neoplasie ematologiche | da 1 mese a 18 anni | 2.5 mg/kg due volte al giorno | Iniziare prima del trapianto o della chemioterapia |
| Dosi endovenose per le infezioni sistemiche | da 1 mese a 18 anni | 2.5 mg/kg (max 200 mg) ogni 12 ore per i primi due giorni, poi una volta al giorno per un massimo di 12 giorni | Come prescritto |
Controllare le informazioni aggiuntive su questo farmaco. Le informazioni sono fornite dall’Agenzia Italiana del Farmaco (AIFA).
Effetti collaterali

In Italia, gli effetti collaterali più frequentemente segnalati dell’Itraconazolo includono disturbi gastrointestinali come nausea, dolore addominale e diarrea. Alcuni pazienti possono accusare mal di testa o vertigini. Anche le anomalie degli enzimi epatici e l’eruzione cutanea sono effetti avversi comuni, sebbene tendano a essere rari. I pazienti che utilizzano l’itraconazolo devono essere monitorati per questi effetti collaterali, soprattutto durante un trattamento prolungato.
Gli effetti avversi più comuni associati all’itraconazolo includono dispepsia, dolore addominale, nausea, vomito, costipazione, diarrea, cefalea e vertigini. Altre includono reazioni allergiche come prurito, rash, orticaria e angioedema. Casi isolati di sindrome di Stevens-Johnson sono stati associati all’itraconazolo. In alcuni pazienti si è verificato un aumento dei valori degli enzimi epatici e sono stati osservati casi di epatite e ittero colestatico, soprattutto nei pazienti trattati per più di un mese.
Si sono verificati rari casi di insufficienza epatica e morte. Raramente sono stati segnalati insufficienza cardiaca ed edema polmonare e gravi eventi cardiovascolari, tra cui aritmie e morte improvvisa, sono stati attribuiti a interazioni farmacologiche in pazienti che ricevevano itraconazolo (vedere Interazioni sotto). Alopecia, edema e ipokaliemia sono stati associati anche all’uso prolungato.
In alcuni pazienti sono stati segnalati disturbi mestruali e neuropatia periferica.
Incidenza degli effetti avversi
L’itraconazolo da 50 a 400 mg al giorno per una media di 5 mesi è stato considerato ben tollerato in 189 pazienti con infezioni fungine sistemiche. Su 86 pazienti con patologie di base, tra cui 49 con AIDS, 16 con diabete e 23 con neoplasie, si sono verificati nausea e vomito in 19 pazienti, ipertrigliceridemia in 16, ipokaliemia in 11 ed elevati valori degli enzimi epatici in 13. Non è stato possibile valutare il ruolo dell’itraconazolo nell’ipertrigliceridemia perché tutti i campioni non sono stati prelevati a digiuno e l’ipertrigliceridemia è una complicanza dell’infezione da HIV.
La ginecomastia si è verificata in 2 pazienti, 1 dei quali assumeva anche spironolattone.
In 4 pazienti si è verificato un rash. Su 49 pazienti che hanno assunto itraconazolo da 100 a 400 mg al giorno per un massimo di 39 mesi, 23 non hanno manifestato effetti avversi durante il trattamento, mentre 6 hanno avuto nausea e vomito, 5 hanno sviluppato edema e 2 hanno sviluppato ipertensione 3 dei pazienti che hanno sviluppato edema e 1 che è diventato iperteso erano diabetici. Tre pazienti hanno interrotto il trattamento con itraconazolo, 1 a causa del vomito, 1 a causa della leucopenia e 1 a causa della sindrome nefrosica. Il paziente con la sindrome nefrosica aveva un edema e un’ipertensione preesistenti. La sindrome è scomparsa con la sospensione dell’itraconazolo.
Cardiovascolare
La fibrillazione ventricolare è stata attribuita all’ipokaliemia indotta dall’itraconazolo.
In una donna trattata con itraconazolo 200 mg al giorno per un’infezione polmonare localizzata da Aspergillus fumigatus si è sviluppato un versamento pleurico e successivamente pericardico. Dopo oltre 9 settimane di trattamento, la donna ha sviluppato un versamento pericardico che ha richiesto un drenaggio. L’itraconazolo è stato ritirato. Sei settimane dopo, e 2 settimane dopo la ripresa dell’itraconazolo, ha sviluppato segni di edema polmonare e di ingrossamento cardiaco. Questi segni sono scomparsi rapidamente alla sospensione dell’itraconazolo.
Studi su cani e volontari umani sani hanno suggerito che l’itraconazolo ha un effetto inotropo negativo; il meccanismo è sconosciuto. Un’analisi sistematica dei dati dell’Adverse Event Reporting System (AERS) dell’FDA ha identificato 58 casi suggestivi di insufficienza cardiaca congestizia in pazienti che assumevano itraconazolo. Una ricerca simultanea non ha identificato alcun caso di insufficienza cardiaca congestizia in pazienti che assumevano fluconazolo e ketoconazolo, escludendo la possibilità di un effetto di classe. Di conseguenza, l’etichettatura dell’itraconazolo è stata rivista. L’itraconazolo è ora controindicato per il trattamento dell’onicomicosi in pazienti con evidenza di disfunzione ventricolare.
Per le infezioni fungine sistemiche, i rischi e i benefici dell’itraconazolo devono essere rivalutati se si sviluppano segni o sintomi di insufficienza cardiaca congestizia.
Sistema nervoso
In alcune segnalazioni è stata menzionata la cefalea dovuta all’itraconazolo. Le vertigini sono un disturbo non comune, così come i disturbi dell’umore.
Psicologico, psichiatrico
In una donna di 75 anni sono state segnalate allucinazioni visive con confusione, che si sono verificate in tre occasioni separate, ogni volta circa 2 ore dopo una dose di 200 mg di itraconazolo. I sintomi si sono attenuati spontaneamente nell’arco di circa 8 ore.
Equilibrio elettrolitico
L’ipopotassiemia, che si verifica da sola o in concomitanza con l’ipertensione, è stata riportata regolarmente in una piccola frazione di pazienti. Un marcato edema alle caviglie con aumento di peso è stato osservato in un paziente che assumeva itraconazolo 400 mg/die, per il quale non c’era altra spiegazione che l’uso del farmaco; dopo la sospensione dell’itraconazolo, i sintomi sono scomparsi. Ipopotassiemia ed edema sono stati osservati anche in alcuni pazienti che assumevano una terapia ad alte dosi (600 mg/die), associati a concentrazioni di aldosterone lievemente depresse.
Gastrointestinale
Nei pazienti che assumono itraconazolo possono verificarsi dispepsia, pirosi, nausea, vomito, lieve fastidio epigastrico e diarrea. Questi disturbi gastrointestinali sono generalmente lievi, ma sembrano essere gli effetti avversi più frequenti durante il trattamento. L’incidenza totale degli effetti avversi è stata del 3-5% nei pazienti trattati per micosi superficiali e dell’8% in 99 pazienti trattati per micosi profonde. Uno studio multicentrico ha riportato un’incidenza più vicina al 15%.
In 50 donne con candidosi vaginale acuta, sono stati segnalati effetti avversi in 17 (35%), nausea in sette, cefalea in sei, vertigini in tre e gonfiore in tre, mentre l’attività della transaminasi aspartato è aumentata in una.
Su 1108 pazienti con HIV trattati per candidosi mucosa, 239 hanno riferito sintomi gastrointestinali.
La colite pseudomembranosa è stata segnalata in associazione all’esposizione all’itraconazolo.
Un uomo di 54 anni ha sviluppato nuovi dolori addominali e diarrea non sanguinolenta 1 mese dopo l’esposizione a un ciclo di 7 giorni di itraconazolo orale 200 mg/die. Stava assumendo sertralina, acido valproico e perfenazina in modo cronico e non assumeva farmaci antimicrobici da 6 mesi. La sigmoidoscopia flessibile dopo la progressione clinica ha mostrato pseudomembrane e la successiva valutazione ha escluso altre cause di diarrea. Sebbene la coltura di Clostridium difficile e il dosaggio della tossina siano risultati negativi, forse a causa del ritardo nel prelievo delle feci, il paziente ha risposto a un ciclo di 10 giorni di terapia farmacologica anti-anaerobica ed è stato dimesso con sintomi completamente risolti.
Gli autori hanno proposto che l’itraconazolo avesse alterato la flora fungina residente nel colon.
Fegato
Nella maggior parte delle segnalazioni cliniche sono stati riscontrati casi di aumento delle attività degli enzimi epatici; le alterazioni erano transitorie o scomparivano dopo la sospensione dell’itraconazolo. Non è stata riportata epatotossicità più grave.
È stata segnalata un’iperplasia nodulare focale del fegato in una donna di 38 anni che aveva assunto itraconazolo 200 mg/die per 4 mesi per un’infezione fungina delle unghie. Non aveva assunto altri farmaci nell’anno in cui si è sviluppata l’iperplasia nodulare focale.
Dei tre pazienti, due donne di 62 e 57 anni e un uomo di 75 anni, che hanno sviluppato un danno epatico sintomatico 5-6 settimane dopo l’inizio dell’assunzione di itraconazolo, due presentavano un quadro biochimico di danno epatico colestatico.
Sono stati analizzati tutti gli studi clinici sull’itraconazolo sponsorizzati dalla Janssen Research Foundation per il trattamento dell’onicomicosi, in cui è stata effettuata una valutazione della sicurezza di laboratorio. Non ci sono state differenze significative nel numero di anomalie di codice 4 (il valore basale è nell’intervallo di riferimento e almeno due valori, o l’ultimo test nel periodo di osservazione, superano il doppio del limite superiore dell’intervallo di riferimento) nei test di funzionalità epatica (alanina transaminasi, aspartato transaminasi, fosfatasi alcalina e bilirubina totale). L’incidenza di tutte le anomalie del codice 4 era inferiore al 2%. La terapia a impulsi con itraconazolo per l’onicomicosi sembra essere sicura, soprattutto dal punto di vista del potenziale danno epatico. Nel foglietto illustrativo dell’itraconazolo si raccomandano test di funzionalità epatica nei pazienti che ricevono itraconazolo in modo continuativo per oltre 1 mese. Non è previsto un simile monitoraggio per il regime a impulsi, a meno che il paziente non abbia un’anamnesi di malattia epatica sottostante, i test di funzionalità epatica siano anormali al basale o si sviluppino in qualsiasi momento segni o sintomi suggestivi di disfunzione epatica.

Pelle
I pazienti che assumono itraconazolo hanno riportato diversi tipi di eruzione cutanea, compresa quella acneiforme. In un caso sono state riscontrate bolle sanguinolente.
Un uomo di 29 anni ha sviluppato un’eruzione maculopapulare infiltrativa dopo 1 settimana di itraconazolo 100 mg al giorno per la tinea corporis. L’itraconazolo è stato ritirato e le lesioni sono scomparse entro 7 giorni. Gli scratch test, i patch test, gli scratch-patch test e i test di stimolazione dei linfociti indotti dal farmaco per l’itraconazolo sono risultati negativi; tuttavia, il rechallenge con itraconazolo sistemico ha indotto un’eruzione maculopapulare sul viso, sulle mani e sulla parte dorsale dei piedi. Le capsule vuote di itraconazolo non hanno avuto effetti cutanei, suggerendo una reazione allergica a un metabolita del composto.
La fotosensibilità è stata attribuita all’itraconazolo (200 mg qds per 5 giorni), con una riduzione della dose minima di eritema sia per gli UVB (0,12 J/cm) che per gli UVA (20,1 J/cm), un patch test fotografico negativo e un challenge fotografico positivo. Gli autori hanno proposto un meccanismo fotoallergico perché la precedente esposizione all’itraconazolo era stata priva di eventi. Tuttavia, non sono stati forniti dettagli sull’esposizione al sole durante la prima esposizione e sull’intensità dell’esposizione al sole durante la procedura di photo challenge orale. L’eruzione ha risposto agli steroidi orali, il che è più tipico delle reazioni fotoallergiche che di quelle fototossiche.
Il rischio di gravi disturbi cutanei è stato stimato in 61 858 utilizzatori di antimicotici orali, di età compresa tra 20 e 79 anni, identificati nel General Practice Research Database del Regno Unito. Avevano ricevuto almeno una prescrizione per fluconazolo orale, griseofulvina, itraconazolo, ketoconazolo o terbinafina. Il tasso di fondo di reazioni avverse cutanee gravi (corrispondente al mancato uso di antimicotici orali) è stato di 3,9 per 10.000 anni-persona (95% CI = 2,9). I tassi di incidenza per l’uso corrente sono stati 15 per 10.000 anni-persona (1 per l’itraconazolo, 11,1 (3 per la terbinafina, 10 (1 per il fluconazolo e 4,6 (0 per la griseofulvina. I disturbi cutanei associati all’uso di antimicotici orali in questo studio sono stati tutti lievi.
Funzione sessuale
Esistono rapporti incoerenti sugli effetti dell’itraconazolo sugli steroidi sessuali. Le concentrazioni di testosterone, corticosterone e progesterone sono rimaste invariate nei ratti e in sei cani in cui sono stati studiati possibili effetti endocrini. D’altra parte, la somministrazione di itraconazolo a sette volontari maschi per due settimane non ha prodotto cambiamenti rilevabili nelle concentrazioni plasmatiche di testosterone o cortisolo. Due settimane dopo l’inizio della terapia con itraconazolo ad alte dosi (600 mg/die), uno degli otto pazienti con micosi grave ha mostrato una risposta leggermente ridotta del cortisolo alla stimolazione con ACTH.
È stata segnalata impotenza erettile, con concentrazioni di steroidi normali, e una riduzione della libido.
Immunologico
L’itraconazolo 200 mg al giorno per 2 settimane ha causato una reazione simile alla malattia da siero in una donna di 53 anni con malattia di Meniere.
La maggior parte degli effetti avversi segnalati dell’itraconazolo sono transitori. Non sono rare le reazioni gastrointestinali, lieve dispepsia, pirosi, nausea, vomito, diarrea e dolore epigastrico. In molti dei rapporti pubblicati si parla di aumenti delle attività degli enzimi epatici sierici e di ipertrigliceridemia, ed è stata segnalata una tossicità epatica sintomatica. L’itraconazolo non induce gli enzimi di metabolizzazione dei farmaci ed è un inibitore più debole degli enzimi microsomiali rispetto al ketoconazolo. Nei ratti a cui sono state somministrate dosi fino a 160 mg/kg, non si è verificata alcuna induzione o inibizione del metabolismo degli xenobiotici.
L’ipopotassiemia è stata spesso segnalata senza una spiegazione del meccanismo. Dosi più elevate (400 o addirittura 600 mg/die) causano un’aumentata incidenza di effetti avversi; tra quelli documentati a questi dosaggi vi sono ipopotassiemia grave, insufficienza surrenalica reversibile e (in un caso pubblicato) aritmie, queste ultime legate a un’interazione con la terfenadina. Sono stati segnalati eruzioni cutanee e prurito. Non sono stati descritti effetti di induzione tumorale.
Gli effetti avversi più comuni nei pazienti che hanno assunto capsule di itraconazolo per periodi prolungati sono stati nausea e vomito (meno del 10%), ipertrigliceridemia (9%), ipopotassiemia (6%), aumento delle transaminasi (5%), eruzioni cutanee e/o prurito (2%), cefalea o vertigini (meno del 2%) ed edema del piede (1%).
In uno studio che ha utilizzato il General Practice Research Database del Regno Unito per determinare i tassi di rari effetti avversi gravi indotti da farmaci su fegato, reni, pelle o sangue, verificatisi entro 45 giorni dal completamento di una prescrizione o di una ricarica in 54 803 utilizzatori di fluconazolo o itraconazolo, un paziente ha avuto un test di funzionalità epatica anormale durante l’assunzione di itraconazolo in cui non è stato possibile escludere un’eziologia indotta dal farmaco, un tasso di 3,2 per 100 000 prescrizioni (95% CI per effetti avversi gravi sul fegato. Pertanto, l’itraconazolo non ha comunemente effetti avversi gravi su fegato, reni, pelle o sangue.
Interazioni
| Categoria | Farmaco | Interazione con itraconazolo | Effetti |
|---|---|---|---|
| Statine | Atorvastatina | Aumento delle concentrazioni sieriche a causa dell’inibizione del CYP3A4. | AUC aumentata del 150%, Cmax aumentata del 38%, emivita prolungata del 30%. |
| Cerivastatina | Modesto aumento delle concentrazioni sieriche; la via secondaria del CYP2C8 non è influenzata dall’itraconazolo. | Piccoli aumenti di AUC, Cmax ed emivita (rispettivamente fino al 51%, 25% e 23%). | |
| Fluvastatina | Nessun effetto significativo su Cmax o AUC; leggero prolungamento dell’emivita. | Interazione minima; considerata sicura con itraconazolo. | |
| Lovastatina | Aumenta notevolmente le concentrazioni plasmatiche anche a basse dosi di itraconazolo. | La Cmax è aumentata di ~15 volte, l’AUC totale è aumentata di >15 volte; si consiglia cautela. | |
| Pravastatina | Leggero aumento dell’AUC e della Cmax; variazioni non statisticamente significative. | L’emivita rimane invariata; l’interazione osservata è minima. | |
| Simvastatina | Esposizione sistemica notevolmente aumentata in associazione con itraconazolo. | La Cmax e l’AUC sono aumentate di almeno 10 volte; in alcuni casi è stato osservato un rischio significativo di rabdomiolisi. | |
| Glucocorticoidi | Budesonide | Aumento dell’inibizione della clearance metabolica con conseguente insufficienza surrenalica in alcuni pazienti. | L’AUC è aumentata di 4,2 volte, l’emivita è stata prolungata da 1,6 a 6,2 ore; è stata osservata una significativa soppressione del cortisolo. |
| Desametasone | Esposizione sistemica ed effetti notevolmente aumentati a causa della riduzione della clearance da parte dell’itraconazolo. | L’AUC è aumentata di quasi quattro volte, l’emivita è stata prolungata di oltre tre volte; si è osservata una riduzione dei livelli di cortisolo. | |
| Metilprednisolone | Aumento significativo dell’esposizione dovuto all’inibizione del CYP3A4 da parte dell’itraconazolo. | L’AUC è aumentata di 3,9 volte, l’emivita è stata prolungata da 2,1 a 4,8 ore; è stata osservata una maggiore soppressione surrenalica. | |
| Prednisolone | Interazione minore con significato clinico limitato rispetto al metilprednisolone. | L’AUC è aumentata del 24%, l’emivita è stata prolungata del 29%; l’uso con itraconazolo è generalmente sicuro. |
Altre interazioni
Tacrolimus
Le concentrazioni e la tossicità del tacrolimus sono influenzate dall’itraconazolo.
- In un uomo di 17 anni affetto da fibrosi cistica che ha ricevuto un trapianto epato-polmonare, si è verificata un’interazione tra itraconazolo 600 mg al giorno e tacrolimus. Sono state osservate elevate concentrazioni di tacrolimus, nonostante il dosaggio relativamente basso (0,1-0,3 mg/kg/die).
- In un altro paziente si è verificata un’interazione tra tacrolimus 0,085 mg /kg/die e itraconazolo 200-400 mg al giorno, con conseguente chetoacidosi, neutropenia e trombocitopenia, che ha richiesto la sospensione di entrambi i farmaci.
- Un uomo di 30 anni con un trapianto renale ha avuto un aumento di oltre due volte delle concentrazioni di tacrolimus nel sangue dopo aver iniziato ad assumere itraconazolo 200 mg/die, accompagnato da una riduzione della velocità di filtrazione glomerulare e da una tubulopatia associata a tacrolimus dimostrata dalla biopsia.
Poiché il tacrolimus ha un indice terapeutico ristretto, le concentrazioni ematiche devono essere monitorate con particolare attenzione in caso di co-somministrazione di itraconazolo e può essere necessario modificare il dosaggio di tacrolimus.
L’interazione di itraconazolo (100 mg bd) con tacrolimus è stata studiata in 28 riceventi di trapianto di cuore o di polmone. Le concentrazioni ematiche di tacrolimus sono state monitorate a giorni alterni per un massimo di 21 giorni dopo l’inizio della terapia con itraconazolo o la sua sospensione. La dose di tacrolimus è stata regolata per mantenere la concentrazione ematica trogolare a 12 ore a 7-12 microgrammi/ml.
La dose media di tacrolimus durante la terapia con itraconazolo è diminuita significativamente da 8,4 a 2,9 mg/die. Non si sono verificati cambiamenti significativi nella creatinina sierica o nei test di funzionalità epatica. Nei pazienti in cui l’itraconazolo è stato ritirato, la dose media di tacrolimus richiesta è aumentata significativamente da 4,7 a 8,8 mg/die. Pertanto, sono stati necessari cambiamenti sostanziali nella dose di tacrolimus sia quando l’itraconazolo è stato iniziato che quando è stato ritirato, ed è stato difficile mantenere le concentrazioni ematiche di tacrolimus entro il range target durante le prime 2 settimane. Tuttavia, non si sono verificati casi di tossicità maggiore o di rigetto.
La co-somministrazione di itraconazolo può ridurre il costo dell’immunosoppressione post-trapianto. Questa interazione è probabilmente dovuta all’inibizione del CYP3A4 da parte dell’itraconazolo.
Alcaloidi della Vinca
L’aumento della neurotossicità degli alcaloidi della vinca, potenzialmente pericolosa per la vita, in seguito alla terapia concomitante con itraconazolo, è stato oggetto di numerose e convincenti segnalazioni. Il potenziamento della neurotossicità della vincristina provoca polineuropatia e ileo paralitico. L’interazione è reversibile e la lettura degli alcaloidi della vinca può essere sicura dopo un washout prolungato. Il meccanismo non è stato formalmente chiarito, ma potrebbe essere una competizione per il metabolismo ossidativo, con conseguente aumento dell’esposizione sistemica, o l’inibizione della pompa di efflusso della glicoproteina P transmembrana, con conseguente aumento delle concentrazioni intracellulari di alcaloidi della vinca. L’uso concomitante di itraconazolo e alcaloidi della vinca è quindi controindicato.
Due adulti con leucemia linfoblastica acuta hanno sviluppato una neurotossicità insolitamente grave causata dalla vincristina, probabilmente dovuta a un’interazione con la sospensione di itraconazolo.
Warfarin
L’itraconazolo può alterare le concentrazioni di warfarin.
In seguito all’aggiunta di itraconazolo a un regime terapeutico comprendente warfarin, ranitidina e terfenadina, in un uomo di 62 anni si sono sviluppate disritmie cardiache. I segni e i sintomi comprendevano il prolungamento dell’intervallo QT e la fibrillazione ventricolare.
Questo particolare regime sembra aver provocato una seconda interazione, poiché sono state riscontrate concentrazioni inaspettatamente elevate di terfenadina. Altri hanno descritto questo fenomeno, che comporta un marcato aumento delle concentrazioni sieriche di terfenadina e una maggiore tossicità del farmaco durante l’ingestione concomitante di itraconazolo. Il meccanismo non è noto, ma è probabilmente legato all’inibizione del CYP3A4.
Zolpidem
Lo zolpidem viene trasformato principalmente dal CYP3A4. Tuttavia, itraconazolo 200 mg non ha alterato la farmacocinetica e la farmacodinamica di zolpidem 10 mg in 10 volontari sani. Pertanto, lo zolpidem può essere usato in dosi normali o quasi normali insieme all’itraconazolo.
Amfotericina
Sono stati utilizzati sei ceppi di A. fumigates per testare gli effetti in vitro della combinazione di amfotericina e itraconazolo. Dopo il pretrattamento, è stato riscontrato un effetto antagonista per tutti i ceppi in vitro e per un ceppo in un modello murino di aspergillosi.
L’effetto della combinazione di itraconazolo e amfotericina sulle attività enzimatiche epatiche è stato studiato retrospettivamente in 20 pazienti con neoplasie ematologiche o malattie polmonari croniche complicate da infezioni o colonizzazioni fungine. Hanno assunto itraconazolo 200-600 mg/die per una mediana di 143 (range 44 giorni). Nove pazienti non avevano test di funzionalità epatica anormali, compresi periodi di alte concentrazioni di itraconazolo (oltre 5000 µg/ml) e del suo metabolita idrossilato attivo; solo uno aveva ricevuto amfotericina in concomitanza. Tutti gli 11 pazienti con anomalie della funzionalità epatica avevano ricevuto amfotericina in concomitanza.
Per ogni paziente, le anomalie della funzionalità epatica erano maggiori durante la terapia concomitante con entrambi i farmaci antimicotici. Sebbene le anomalie degli enzimi epatici non siano comuni con l’amfotericina e sebbene questa analisi retrospettiva sia soggetta a diversi difetti e potenziali pregiudizi, suggerisce comunque che l’epatotossicità dovrebbe essere attentamente monitorata in caso di co-somministrazione di itraconazolo e amfotericina.
Antistaminici
Sembra probabile che la combinazione di itraconazolo con astemizolo e terfenadina determini un aumento degli effetti di questi antistaminici.
Barbiturici
I barbiturici riducono le concentrazioni di itraconazolo.
Benzodiazepine
L’effetto dell’itraconazolo sulla farmacocinetica e sulla farmacodinamica dell’estazolam in una singola dose orale è stato studiato in uno studio in doppio cieco, randomizzato e crossover su 10 volontari sani di sesso maschile, che hanno assunto per via orale itraconazolo 100 mg/die o placebo per 7 giorni e il quarto giorno una singola dose orale di estazolam 4 mg. I prelievi di sangue e la valutazione della funzione psicomotoria mediante il test di sostituzione delle cifre, la scala analogica visiva e la scala della sonnolenza di Stanford sono stati condotti fino a 72 ore dopo l’estazolam. Non è stata riscontrata alcuna differenza significativa tra la fase con placebo e quella con itraconazolo per quanto riguarda il picco di concentrazione plasmatica, la clearance e l’emivita. Allo stesso modo, la funzione psico-motoria non è stata influenzata. Questi risultati suggeriscono che il CYP3A4 non è coinvolto in misura rilevante nel metabolismo dell’estazolam.
In uno studio sugli effetti dell’itraconazolo 200 mg/die e della rifampicina 600 mg/die sulla farmacocinetica e farmacodinamica del midazolam orale 7,5-15 mg durante e 4 giorni dopo la fine del trattamento, il passaggio dall’inibizione all’induzione del metabolismo ha causato una variazione fino a 400 volte dell’AUC del midazolam orale.
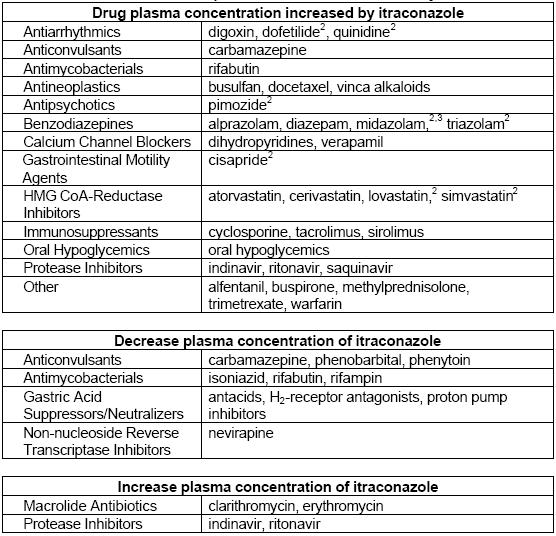
Bupivacaina
L’interazione di itraconazolo 200 mg per via orale per 4 giorni con una singola dose endovenosa di bupivacaina racemica (0,3 mg /kg somministrata in 60 minuti) è stata esaminata in uno studio crossover controllato con placebo su 10 volontari sani. L’itraconazolo ha ridotto la clearance della R-bupivacaina del 21% e quella della 5-bupivacaina del 25%, ma non ha avuto altri effetti significativi sulla farmacocinetica degli enantiomeri. La riduzione della clearance della bupivacaina da parte dell’itraconazolo è in grado di aumentare le concentrazioni allo stato stazionario degli enantiomeri della bupivacaina del 20-25%, e questo deve essere tenuto in considerazione nell’uso concomitante di itraconazolo e bupivacaina.
Buspirone
L’interazione dell’itraconazolo con il metabolita attivo l-(2-pirimidinil)-piperazina del buspirone è stata studiata dopo una singola dose orale di buspirone 10 mg. L’itraconazolo ha ridotto l’AUC media del metabolita del 50% e la Cmax del 57%, mentre l’AUC e la Cmax medie del farmaco progenitore sono aumentate rispettivamente di 14,5 volte e 10,5 volte. Pertanto, l’itraconazolo ha causato cambiamenti relativamente minori nelle concentrazioni plasmatiche del metabolita piperazino attivo del buspirone, sebbene abbia avuto effetti importanti sulle concentrazioni di buspirone dopo una singola dose orale.
Busulfan
Sono state segnalate una riduzione dell’eliminazione e un aumento della tossicità del busulfano in co-somministrazione con itraconazolo.
Carbamazepina
Sono state osservate concentrazioni sieriche basse e talvolta molto basse di itraconazolo durante la terapia concomitante di itraconazolo con carbamazepina.
Ciclosporina
La combinazione di itraconazolo e ciclosporina determina un marcato aumento delle concentrazioni ematiche di ciclosporina, che può aumentare la creatinina sierica. Ciò indica chiaramente un danno renale causato dalle elevate concentrazioni di ciclosporina. Tuttavia, l’interazione non è stata dimostrata in tutti i casi.
Sono stati riportati due casi di rabdomiolisi causata dall’itraconazolo in riceventi di trapianto cardiaco che assumevano ciclosporina e simvastatina a lungo termine. Per evitare una grave miopatia, le concentrazioni di ciclosporina devono essere monitorate frequentemente e le statine devono essere ritirate o il loro dosaggio deve essere ridotto, finché gli azoli devono essere prescritti nei riceventi di trapianto. I pazienti devono essere istruiti sui segni e i sintomi che richiedono l’intervento immediato del medico.
Tampone citrato-fosfato
Il tampone citrato-fosfato utilizzato per facilitare l’assorbimento della dideossinosina (didanosina), prescritta per il trattamento dell’AIDS, può interferire con l’assorbimento dell’itraconazolo.
Claritromicina
Un rapporto su tre pazienti HIV-negativi ha suggerito che la terapia concomitante con itraconazolo e claritromicina può portare a un aumento dell’esposizione alla claritromicina, con un aumento del rapporto metabolico, forse legato all’effetto dell’itraconazolo sul CYP3A4. Tuttavia, in nessuno dei tre soggetti segnalati si sono verificati effetti avversi dovuti a questa presunta interazione.
Clozapina
L’itraconazolo 200 mg non ha avuto effetti significativi sulle concentrazioni sieriche di clozapina 200-550 mg/die o di desmetilclozapina in 7 pazienti schizofrenici.
Digossina
L’itraconazolo inibisce l’eliminazione della digossina, con conseguente tossicità.
L’itraconazolo aumenta l’AUC0_72 della digossina di circa il 50% e ne riduce la clearance renale di circa il 20%. Oltre all’inibizione della secrezione renale della digossina, probabilmente mediata dall’inibizione della glicoproteina P, uno studio condotto su cavie ha dimostrato anche una significativa riduzione dell’escrezione biliare della digossina da parte dell’itraconazolo, suggerendo che l’interazione tra itraconazolo e digossina potrebbe essere dovuta non solo a una riduzione della clearance renale, ma anche a una riduzione della clearance metabolica della digossina da parte dell’itraconazolo.
L’importanza di questa interazione è stata sottolineata dalla segnalazione di due pazienti sottoposti a trapianto renale che hanno manifestato tossicità da digossina in concomitanza con l’assunzione di itraconazolo.
Famotidina
La famotidina 40 mg/kg/die ha ridotto le concentrazioni di picco e di trogolo dell’itraconazolo 200 mg/kg/die di circa il 35% in 18 pazienti sottoposti a chemioterapia per tumori ematologici.
Fentanil
Il fentanil è un substrato dei CYP3A4, CYP2C9 e CYP2C19. Tuttavia, in uno studio, la farmacocinetica e la farmacodinamica del fentanil 3 microgrammi/kg erano simili dopo itraconazolo 200 mg e placebo in 10 volontari sani.
È stata segnalata un’interazione dell’itraconazolo con il fentanil in un uomo di 67 anni con cancro che assumeva una dose stabile di fentanil transdermico di 50 microgrammi/ora. L’uomo ha assunto itraconazolo 200 mg al giorno per una candidosi orofaringea e, 24 ore dopo, ha sviluppato segni di tossicità da oppioidi, che sono stati eliminati con la sospensione del fentanil e la sostituzione con oppioidi a breve durata d’azione.
Potrebbe trattarsi di un’interazione a cui solo alcuni individui sono suscettibili.
Flucitosina
La combinazione di itraconazolo e flucitosina può potenziarne l’attività contro i funghi neri; questa combinazione ha impedito lo sviluppo di resistenza alla flucitosina.
Il paziente o chi lo assiste deve chiamare subito il 112 per contattare i servizi medici di emergenza in Italia per qualsiasi emergenza medica, compresa un’overdose.
Importanti informazioni sulla sicurezza
In Italia sta crescendo la consapevolezza dell’uso eccessivo di farmaci antimicotici come l’itraconazolo, con campagne di salute pubblica che incoraggiano migliori pratiche di prescrizione. Recenti linee guida hanno sottolineato l’importanza di indirizzare i farmaci verso specifici patogeni fungini per ridurre al minimo i trattamenti non necessari. Inoltre, il sistema sanitario italiano sta monitorando costantemente la sicurezza dei trattamenti antimicotici, incluso l’Itraconazolo, come parte di una più ampia iniziativa per ridurre la resistenza antimicrobica.
Età
La sicurezza, la tollerabilità e la farmacocinetica dell’itraconazolo e del suo metabolita attivo idrossitraconazolo dopo la somministrazione di itraconazolo soluzione in idrossi-propil-P-ciclodestrina sono state analizzate in uno studio multicentrico su 26 neonati e bambini di età compresa tra 6 mesi e 12 anni con candidosi mucosale o a rischio di malattia fungina invasiva. Nei bambini di età compresa tra i 6 mesi e i 2 anni si è osservata una tendenza a ridurre le concentrazioni plasmatiche minime. L’assorbimento sistemico del solubilizzante idrossipropil-P-ciclodestrina è stato inferiore all’1%. Somministrata a 5 mg/ kg/die, questa formulazione ha fornito concentrazioni plasmatiche potenzialmente terapeutiche, leggermente inferiori a quelle raggiunte negli adulti, ed è risultata ben tollerata e sicura.
Itraconazolo 100 mg/die è stato studiato in 24 bambini con tinea capitis da Trichophyton tonsurans. L’itraconazolo è stato ben tollerato, ma 15 bambini hanno richiesto un nuovo trattamento a causa della persistenza dell’infezione.
La sicurezza, la farmacocinetica e la farmacodinamica di una sospensione orale di itraconazolo ciclodestrina (2,5 mg /kg odd o bd per 15 giorni) sono state analizzate in uno studio in aperto, sequenziale, a dose scalare in 26 bambini e adolescenti, di età compresa tra i 5 e i 18 anni, infettati con HIV (conta media dei CD4 128 x 106/1) con candidosi orofaringea. A parte disturbi gastrointestinali da lievi a moderati in tre pazienti, l’itraconazolo ciclodestrina è stato ben tollerato.
Due pazienti si sono ritirati prematuramente a causa di eventi avversi. Il punteggio della candidosi orofaringea è diminuito significativamente da una media di 7,46 al basale a 2,8 alla fine della terapia, dimostrando l’efficacia antimicotica in questo contesto. Sulla base di questi risultati, è stato raccomandato un dosaggio di 2,5 mg/ kg/die per il trattamento della candidosi orofaringea nei bambini di età pari o superiore a 5 anni.
La sicurezza e l’efficacia dell’itraconazolo ciclodestrina orale (5 mg/kg/die) come profilassi antimicotica sono state valutate in uno studio in aperto su 103 bambini neutropenici (età mediana 5 anni; range 0-15 anni). La profilassi è stata iniziata almeno 7 giorni prima dell’insorgenza della neutropenia e proseguita fino al recupero dei neutrofili. Dei 103 pazienti, solo 47 hanno completato il ciclo di profilassi; 27 si sono ritirati per scarsa compliance, 19 per eventi avversi e 10 per altri motivi. Eventi avversi gravi (diversi dal decesso) si sono verificati in 21 pazienti, tra cui convulsioni, sospette interazioni farmacologiche, dolore addominale e costipazione. Gli eventi avversi più comuni considerati sicuramente o possibilmente correlati all’itraconazolo sono stati vomito, anomalie della funzionalità epatica e dolore addominale.
La tollerabilità del farmaco in studio all’endpoint è stata giudicata buona (55%), moderata (11%), scarsa (17%) o inaccettabile (17%). Non si sono verificati problemi inattesi di sicurezza o tollerabilità.
Gravidanza, fertilità e allattamento
Sebbene non esistano studi adeguati e controllati sull’uomo, l’itraconazolo ha dimostrato di essere teratogeno ed embriotossico negli animali. Pertanto, l’itraconazolo deve essere usato in gravidanza solo quando i potenziali benefici giustificano i possibili rischi per il feto.
Per il trattamento dell’onicomicosi, l’uso di itraconazolo è controindicato nelle donne in gravidanza ed è controindicato anche nelle donne che prevedono una gravidanza.
Se la terapia con itraconazolo per il trattamento dell’onicomicosi viene iniziata in una donna con potenziale fertile, la prima dose del farmaco deve essere somministrata il secondo o il terzo giorno del successivo periodo mestruale normale, e devono essere prese misure per garantire che venga mantenuta una contraccezione efficace per tutta la durata della terapia con itraconazolo e per altri 2 mesi dopo la sospensione del farmaco. Negli studi sulla riproduzione, l’itraconazolo ha causato un aumento dose-correlato della tossicità materna, dell’embriotossicità e della teratogenicità nei ratti a dosaggi di circa 40-160 mg/kg al giorno (5-20 volte il dosaggio massimo raccomandato per l’uomo) e nei topi a dosaggi di circa 80 mg/kg al giorno (10 volte il dosaggio massimo raccomandato per l’uomo).
La teratogenicità consisteva in difetti scheletrici importanti nei ratti e in encefaloceli e/o macroglossia nei topi.
Sebbene sia stata osservata una tossicità parentale, gli studi sulla riproduzione in ratti maschi e femmine che ricevevano dosi di itraconazolo per via orale fino a 40 mg/kg al giorno (5 volte la dose massima raccomandata per l’uomo) non hanno rivelato prove di compromissione della fertilità. Una tossicità parentale più grave, compresa la morte, si è verificata a un dosaggio di 160 mg/kg al giorno (20 volte il dosaggio massimo raccomandato per l’uomo).
L’itraconazolo si distribuisce nel latte umano e i benefici attesi dall’itraconazolo per la donna che allatta devono essere soppesati rispetto al rischio potenziale per il neonato derivante dall’esposizione al farmaco. A causa della potenziale trasmissione dell’HIV a un bambino non infetto, i Centri statunitensi per il controllo e la prevenzione delle malattie (CDC) raccomandano attualmente che le donne infette da HIV non allattino i neonati.
Precauzioni relative agli effetti cardiovascolari
Insufficienza cardiaca congestizia, edema periferico ed edema polmonare sono stati segnalati in pazienti immunocompromessi o immunocompetenti che ricevevano itraconazolo per via endovenosa o orale per il trattamento di infezioni fungine sistemiche e in pazienti immunocompetenti che ricevevano capsule di itraconazolo per via orale per il trattamento dell’onicomicosi. Le capsule di itraconazolo non devono essere usate per trattare l’onicomicosi in pazienti con evidenza di disfunzione ventricolare, come l’insufficienza cardiaca congestizia, o con un’anamnesi di insufficienza cardiaca congestizia.
Per altre indicazioni (ad esempio, trattamento di infezioni fungine sistemiche) in pazienti con evidenza di disfunzione ventricolare, l’itraconazolo per via endovenosa o orale deve essere usato solo quando i benefici superano chiaramente i rischi.
I medici devono esaminare attentamente i rischi e i benefici della terapia con itraconazolo nei pazienti con fattori di rischio per l’insufficienza cardiaca congestizia (ad esempio, quelli con malattie cardiache come la malattia ischemica e valvolare, malattie polmonari clinicamente importanti come la broncopneumopatia cronica ostruttiva, o insufficienza renale e altri disturbi edematosi), e l’itraconazolo per via endovenosa e l’itraconazolo soluzione orale devono essere usati con cautela in questi pazienti.
Se l’itraconazolo è considerato necessario in pazienti con fattori di rischio per l’insufficienza cardiaca congestizia, questi devono essere informati dei segni e dei sintomi dell’insufficienza cardiaca congestizia e monitorati attentamente durante la terapia. I pazienti che sviluppano un’insufficienza cardiaca congestizia durante la somministrazione di itraconazolo capsule orali devono interrompere il farmaco. Se si verifica un’insufficienza cardiaca congestizia durante la terapia con itraconazolo per via endovenosa o itraconazolo soluzione orale, il paziente deve essere attentamente monitorato e devono essere valutate le opzioni terapeutiche (compresa l’eventuale sospensione del farmaco).
Poiché l’itraconazolo e il suo principale metabolita, l’idrossitraconazolo, sono potenti inibitori del sistema isoenzimatico del citocromo P-450 (CYP) 3A4, l’uso concomitante dell’agente antimicotico con farmaci metabolizzati da questi enzimi può aumentare le concentrazioni plasmatiche di questi farmaci con conseguente potenziale aumento dei loro effetti terapeutici e avversi. Sono stati segnalati gravi effetti avversi cardiovascolari (prolungamento del QT, torsades de pointes, tachicardia ventricolare, arresto cardiaco e/o morte improvvisa) in pazienti che ricevevano itraconazolo in concomitanza con alcuni farmaci metabolizzati dagli enzimi CYP3A4 (per esempio, cisapride, dofetilide, pimozide, chinidina) e l’uso concomitante con questi farmaci è controindicato.
Precauzioni relative agli effetti epatici
Poiché con l’itraconazolo sono stati segnalati rari casi di epatotossicità grave, compresi alcuni casi nella prima settimana di terapia, la terapia con itraconazolo non deve essere utilizzata in pazienti con aumento degli enzimi epatici sierici, malattia epatica attiva o anamnesi di tossicità epatica con altri farmaci, a meno che i potenziali benefici non superino i rischi. Le concentrazioni degli enzimi epatici sierici devono essere monitorate in tutti i pazienti con anomalie della funzione epatica preesistenti e in quelli che hanno sperimentato tossicità epatica con altri farmaci.
Inoltre, il monitoraggio degli enzimi sierici deve essere preso in considerazione per tutti i pazienti che ricevono itraconazolo, in particolare quelli che ricevono la terapia con itraconazolo in modo continuativo per più di 1 mese. L’itraconazolo deve essere interrotto immediatamente e devono essere eseguiti test di funzionalità epatica se durante la terapia si sviluppano segni e sintomi compatibili con una malattia epatica. I rischi e i benefici dell’itraconazolo devono essere rivalutati in questi pazienti. I pazienti devono essere istruiti a sospendere immediatamente l’itraconazolo e a contattare il proprio medico se si manifestano segni o sintomi di disfunzione epatica, tra cui affaticamento insolito, urine scure, feci pallide, anoressia, nausea, vomito o ittero, in modo che possano essere eseguiti gli esami di laboratorio appropriati.
Altre precauzioni e controindicazioni
Se si verifica una neuropatia che potrebbe essere attribuita all’itraconazolo, il farmaco deve essere interrotto. Poiché l’itraconazolo può causare ipopotassiemia, alcuni medici raccomandano di monitorare le concentrazioni sieriche di potassio nei pazienti che ricevono dosaggi relativamente elevati e/o una terapia prolungata con il farmaco. L’itraconazolo è controindicato nei pazienti con ipersensibilità nota al farmaco o a qualsiasi ingrediente della formulazione.
Sebbene non siano disponibili informazioni sulla sensibilità crociata tra itraconazolo e altri agenti antimicotici triazolici o imidazolici, il produttore dichiara che l’itraconazolo deve essere usato con cautela nei soggetti ipersensibili ad altri azoli.
Precauzioni pediatriche
La sicurezza e l’efficacia dell’itraconazolo nei bambini di età inferiore ai 18 anni non sono state stabilite. Un numero limitato di pazienti di età compresa tra i 3 e i 16 anni con infezioni fungine sistemiche non meningee ha ricevuto itraconazolo in capsule al dosaggio di 100 mg al giorno senza effetti avversi insoliti. Inoltre, un numero limitato di pazienti pediatrici di età compresa tra 6 mesi e 12 anni ha ricevuto itraconazolo soluzione orale al dosaggio di 5 mg/kg una volta al giorno per 2 settimane senza effetti avversi insoliti.
Tuttavia, i dati degli studi sugli animali hanno dimostrato che l’itraconazolo induce difetti ossei nei ratti che ricevono dosaggi fino a 20 mg/kg al giorno (2 volte il dosaggio massimo raccomandato per l’uomo). I difetti comprendevano la diminuzione dell’attività delle placche ossee, l’assottigliamento della zona compatta delle grandi ossa e l’aumento della fragilità ossea. A un dosaggio di 80 mg/kg al giorno (10 volte il dosaggio massimo raccomandato per l’uomo) per più di 1 anno o di 160 mg/kg al giorno (20 volte il dosaggio massimo raccomandato per l’uomo), il farmaco ha indotto in alcuni ratti una polpa dentale di piccole dimensioni con aspetto ipocellulare.
Mentre la tossicità ossea osservata negli animali non è stata finora riportata nei pazienti adulti che ricevono il farmaco, l’effetto a lungo termine della terapia con itraconazolo nei bambini non è noto.
Precauzioni in età geriatrica
Gli studi clinici sull’itraconazolo per via endovenosa non hanno incluso un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se i pazienti geriatrici rispondono in modo diverso rispetto ai pazienti più giovani. Sebbene altre esperienze cliniche non abbiano rivelato differenze nella risposta, il dosaggio del farmaco deve essere scelto con cautela nei pazienti geriatrici. Si deve inoltre tenere conto della maggiore frequenza di riduzione della funzionalità epatica, renale e/o cardiaca e di malattie e terapie farmacologiche concomitanti osservate negli anziani.
Mutagenicità e cancerogenicità
Non è stata riscontrata alcuna evidenza di mutagenicità quando l’itraconazolo è stato analizzato in sistemi di test inappropriati su batteri, mammiferi e non mammiferi. Non è stata riscontrata alcuna evidenza di cancerogenicità nei topi che hanno ricevuto itraconazolo per via orale per 23 mesi a dosaggi fino a 80 mg/kg al giorno (circa 10 volte il dosaggio massimo raccomandato per l’uomo). Si è registrato un leggero aumento dell’incidenza di sarcomi dei tessuti molli nei ratti maschi che ricevevano 25 mg/kg al giorno (3,1 volte la dose massima raccomandata per l’uomo). Questi sarcomi potrebbero essere una conseguenza dell’ipercolesterolemia, una risposta alla somministrazione cronica di itraconazolo osservata nei ratti ma non nei cani o nell’uomo.
È stato osservato un aumento dell’incidenza di carcinoma polmonare a cellule squamose in ratti femmina che ricevevano 50 mg/kg di itraconazolo al giorno (6,25 volte la dose massima raccomandata per l’uomo). Sebbene l’insorgenza del carcinoma polmonare a cellule squamose sia estremamente rara nei ratti non trattati, l’aumento dell’incidenza in questo studio non era statisticamente significativo. La soluzione orale di itraconazolo e l’iniezione di itraconazolo disponibili in commercio contengono idrossipropil-b-ciclodestrina (HP-b-CD) come eccipiente. L’HP-b-CD ha prodotto adenocarcinomi pancreatici in studi di cancerogenicità sui ratti, ma effetti simili non sono stati osservati in uno studio di cancerogenicità sui topi.
La rilevanza clinica di questo risultato è sconosciuta. Sulla base di confronti dell’area di superficie corporea, è stato stimato che i pazienti che ricevono il dosaggio abituale di itraconazolo soluzione orale disponibile in commercio sarebbero esposti a concentrazioni di HP-b-CD equivalenti a 1,7 volte l’esposizione della dose più bassa utilizzata nello studio sui ratti.
Resta da stabilire se i risultati degli studi sugli animali che utilizzano HP-b-CD somministrato per via orale siano applicabili all’itraconazolo somministrato per via parenterale.
Altre caratteristiche del paziente
Non si prevedono effetti avversi dovuti a interazioni farmaco-farmaco nei pazienti diabetici che utilizzano insulina e farmaci ipoglicemizzanti orali non metabolizzati dal CYP3A4 (per esempio, tolbutamide, gliclazide, glibenclamide, glipizide e metformina). I dati farmacocinetici e di sicurezza degli studi clinici e della sorveglianza post-marketing sono stati esaminati per valutare la sicurezza dell’itraconazolo nei pazienti diabetici con onicomicosi o dermatomicosi.
La sorveglianza post-marketing, che ha incluso tutte le segnalazioni di eventi avversi in pazienti che assumevano itraconazolo in concomitanza con l’insulina o un farmaco ipoglicemizzante orale, ha rivelato 15 segnalazioni suggestive di iperglicemia e nove segnalazioni suggestive di ipoglicemia. Nella maggior parte dei pazienti, l’effetto antidiabetico non è cambiato. Dagli studi clinici condotti su 189 pazienti diabetici che assumevano itraconazolo per varie infezioni, è stato registrato un evento avverso correlato all’itraconazolo; si trattava di un aggravamento del diabete in un paziente sottoposto a trapianto renale che assumeva anche ciclosporina.
L’itraconazolo ha causato anomalie nello sviluppo fetale nei roditori ed è quindi controindicato in gravidanza.
L’itraconazolo deve essere evitato nei pazienti con insufficienza epatica. La funzionalità epatica deve essere monitorata se il trattamento dura più di un mese o in presenza di sintomi suggestivi di epatite. Il trattamento deve essere interrotto se viene rilevata una funzione epatica anormale.
Le concentrazioni plasmatiche di itraconazolo devono essere monitorate nei pazienti con malattia epatica attiva e, se necessario, il dosaggio deve essere modificato. In alcuni pazienti con insufficienza renale può essere necessario un aggiustamento della dose. Le informazioni sul prodotto in licenza avvertono che l’uso di preparati di itraconazolo per via endovenosa formulati con idrossipropilbetadex è controindicato nei pazienti con una clearance della creatinina inferiore a 30 mL/minuto.
L’itraconazolo deve essere interrotto se si sviluppa una neuropatia. Non deve essere usato per trattare infezioni fungine meno gravi, come l’onicomicosi, in pazienti con evidenza o storia di disfunzione ventricolare, come l’insufficienza cardiaca. L’ipocloridria, che può essere presente nei pazienti con AIDS, può ridurre l’assorbimento dell’itraconazolo. In questo caso, l’assorbimento può essere migliorato somministrando l’itraconazolo con una bevanda acida, come la cola.
Nomi di marca di Itraconazolo più venduti in Italia
- Sporanox;
- Onmel;
- Itrazol;
- Itraconazolo Mylan;
- Itraconazolo Teva.
È possibile ordinare questo farmaco online e pagare con Bancomat Pay, MyBank, Sepa Direct Debit, PostePay o Satispay, alcune delle principali piattaforme di pagamento online italiane.
Farmaci simili in Italia
In Italia, diversi farmaci antimicotici sono simili all’Itraconazolo. Si tratta di Fluconazolo, Ketoconazolo e Voriconazolo, anch’essi utilizzati per il trattamento di varie infezioni fungine.
Preparazioni
| Forma di dosaggio | Forza | Nome del marchio | Composizione/Caratteristiche | Produttore |
|---|---|---|---|---|
| Capsule orali | 100 mg | Sporanox | Disponibile in PulsePak® e in confezioni normali | Janssen |
| Soluzione orale | 10 mg/mL | Sporanox® | Contiene idrossipropil-β-ciclodestrina (400 mg/mL) e glicole propilenico | Ortho Biotech |
| Parenterale per iniezione | 10 mg/mL (250 mg di concentrato per 200 mg di somministrazione endovenosa) | Sporanox® | Contiene idrossipropil-β-ciclodestrina (400 mg/mL), glicole propilenico e diluente di cloruro di sodio allo 0,9%; include un set di infusione filtrante | Ortho Biotech |
Altri nomi di marca in diversi Paesi
| Paese | Nomi di marca |
|---|---|
| Argentina | ITC, Itrac, Micotenk, Nitridazol, Panastat, Salimidin, Sporanox |
| Australia | Sporanox |
| Austria | Itrabene, Sporanox |
| Belgio | Sporanox |
| Brasile | Es-tiranox, Fungonax, Itracotan, Itrahexal-H, Itranax, Itraspor, Itrazol, Neo Itrax, Sporanox, Spozol, Tracnox, Traconal, Traconax, Tracozon, Trana-zol, Tratzol, Traxonol |
| Canada | Sporanox |
| Cile | Itodal, Sporanox, Teramic |
| Repubblica Ceca | Cladostad, Prokanazol, Sporanox |
| Danimarca | Niddazol, Sporanox |
| Finlandia | Sporanox |
| Francia | Sporanox |
| Germania | Canifug, Itra, Itracol, Sempera, Siros |
| Grecia | Assosept-S, Bevonazolo, Brovicton, Deratil, Etrel, Flunol, Idranox, Isoflon, Itrabest, Itracon, Itraconal, Itralfa, Itraviron, Itrazol, Laverio, Lorenzol, Mesmor, Micronazol, Prominox, Soprazon, Sporanox, Sporizole, Stas, Sterginox, Zetilox |
| Hong Kong | Aranox, Quali-itrazolo, Sporanox |
| Ungheria | Cladostad, Omicral, Orungal |
| India | Candistat, Canditral, Itracan |
| Indonesia | Forcanox, Fungitrazol, Furolnok, Itzol, Nufatrac, Sporacid, Sporanox, Spyrocon, Trachon, Unitrac, Zitrazol |
| Irlanda | Sporanox |
| Israele | Itranol, Sporanox |
| Italia | Sporanox, Trazer, Triasporin |
| Malesia | Canditral, Inox, Sporanox, Unitrac |
| Messico | Carexan, Conamed, Congox, Derusil, Ergospharma, Fitocyd, Fulzoltec, Fuzoltec, Imazol, Iqcona, Isoporum, Isox, Itranax, Lozartil, Rixtal, Seritral, Silicsan, Sinozol, Solmavin, Sporanox, Steitraz, Trax, Z-Fin, Zolken |
| Paesi Bassi | Trisporal |
| Norvegia | Sporanox |
| Nuova Zelanda | Sporanox |
| Filippine | Sporanox |
| Polonia | Orungal, Trioxal |
| Portogallo | Sporanox |
| Russia | Irunine, Orungal, Orungamin, Orunit, Rumycoz |
| Sudafrica | Adco-Sporozolo, Sporanox |
| Singapore | Canditral, Sporanox |
| Spagna | Canadiol, Hongoseril, Oromic, Sporanox |
| Svezia | Sporanox |
| Svizzera | Sporanox |
| Thailandia | Canditral, Icona, Itra, Itracon, Norspor, Spazol, Sporal, Sporlab, Spornar |
| Turchia | Funit, Itraspor, Sporex |
| Regno Unito | Sporanox |
| Stati Uniti d’America | Sporanox |
| Venezuela | Fungosin, Sporanox |
Multi-ingrediente
- Messico: Sepia Sporasec
- Venezuela: Sporasec
Ordinate questo farmaco online e fatevelo consegnare da uno dei maggiori corrieri in Italia, come BRT, Poste Italiane, SDA Express Courier, UPS, GLS, TNT, DHL, Nexive e FedEx.

