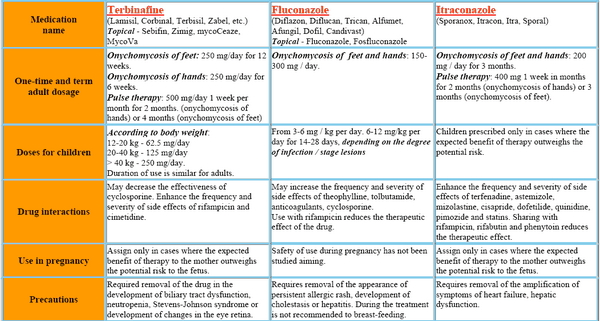
Itraconazol kann zur Behandlung verschiedener oberflächlicher Pilzinfektionen eingesetzt werden, darunter Dermatophytosen, Pityriasis versicolor und mukosale und kutane Formen der Candidose. Es ist auch wirksam bei Patienten mit subkutanen Infektionen wie Chromoblastomykose, Sporotrichose und bestimmten Formen der Phäohyphomykose. Es hat sich zum Mittel der Wahl bei nicht lebensbedrohlichen Formen der Blastomykose und Histoplasmose entwickelt und ist eine Alternative zu Amphotericin B bei invasiver Aspergillose. In Deutschland ist Itraconazol hauptsächlich unter den Markennamen Sporanox und Itraconazol erhältlich. Diese Arzneimittel sind hierzulande weithin anerkannt.
Nomenklatur des Arzneimittels
Therapeutische Klassen von Itraconazol
Antimykotische Mittel, Antimykotische Mittel, Antiprotozoische Mittel, Antiprotozoische Mittel.
Europäisches Arzneibuch, 6. Aufl. (Itraconazol)
Weißes oder fast weißes Pulver. Praktisch unlöslich in Wasser, schwach löslich in Alkohol, gut löslich in Dichlormethan, schwer löslich in Tetrahydrofuran. Vor Licht schützen.
Das Arzneimittel Itraconazol ist von der Europäischen Arzneimittel-Agentur (EMA ) zugelassen und wird auch vom deutschen Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) überwacht. Diese Behörden stellen sicher, dass das Medikament die Sicherheits-, Wirksamkeits- und Qualitätsstandards für die deutsche Bevölkerung erfüllt.
Pharmakokinetik
Die Absorption von Itraconazol aus dem Magen-Darm-Trakt ist unvollständig (etwa 55 %), wird aber verbessert, wenn das Arzneimittel mit der Nahrung verabreicht wird. Die orale Verabreichung einer einzelnen 100-mg-Kapsel führt etwa 2-4 Stunden später zu Spitzen-Serumkonzentrationen zwischen 0,1 und 0,2 mg/l. Höhere Konzentrationen werden nach wiederholter Verabreichung erreicht, doch gibt es deutliche Unterschiede zwischen den einzelnen Personen. Wie bei Ketoconazol steigen die Blutspiegel mit zunehmender Dosierung überproportional an. Die Serumkonzentrationen sind deutlich reduziert, wenn die Magensäureproduktion beeinträchtigt ist.
Wesentlich höhere Blutkonzentrationen (bis zu 1,0-1,5 mg/1) wurden bei AIDS-Patienten und neutropenischen Personen nach Verabreichung einer 5 mg/kg-Dosis der oralen Lösungsformulierung von Itraconazol über 1-2 Wochen erreicht. Diese Formulierung wird besser absorbiert, wenn sie ohne Nahrung verabreicht wird.
Wie die meisten anderen Azol-Antimykotika ist die Proteinbindung von Itraconazol hoch und liegt im menschlichen Serum bei über 99 %. Infolgedessen sind die Konzentrationen des Arzneimittels in Körperflüssigkeiten wie Liquor minimal. Im Gegensatz dazu sind die Konzentrationen des Arzneimittels in Geweben wie Lunge, Leber und Knochen zwei- bis dreimal höher als im Serum. Hohe Konzentrationen von Itraconazol finden sich auch im Stratum corneum als Folge der Sekretion des Wirkstoffs in den Talg. Es wurde festgestellt, dass Itraconazol 2-4 Wochen nach Ende einer 4-wöchigen Behandlung in der Haut verbleibt. In den Zehennägeln verbleibt es bis zu 6 Monate nach Beendigung einer 3-monatigen Behandlung, aber die Konzentrationen in den Fingernägeln nehmen etwa 3 Monate nach Behandlungsende ab.
Weniger als 0,03 % einer verabreichten Itraconazol-Dosis werden unverändert mit dem Urin ausgeschieden, aber bis zu 18 % werden mit den Fäkalien als unverändertes Arzneimittel ausgeschieden.
Studien und klinische Prüfungen in Deutschland
In Deutschland wurden mehrere Studien zur Bewertung der Wirksamkeit und Sicherheit von Itraconazol durchgeführt. Diese Studien konzentrieren sich in der Regel auf den Einsatz von Itraconazol bei der Behandlung einer Vielzahl von Pilzinfektionen, insbesondere bei Patienten mit geschwächtem Immunsystem. Forscher in deutschen Krankenhäusern haben untersucht, wie Itraconazol mit anderen Medikamenten zusammenwirkt und wie es für bessere Behandlungsergebnisse optimiert werden kann. Die Ergebnisse dieser Studien haben gezeigt, dass Itraconazol bei der Behandlung von Krankheiten wie Aspergillose, Candidose und Onychomykose wirksam ist, wobei die Studien bestätigen, dass es in verschiedenen Geweben therapeutische Werte erreichen kann. Darüber hinaus haben die Daten aus diesen Studien sein Nebenwirkungsprofil und seine Wirksamkeit sowohl bei Kurzzeit- als auch bei Langzeitbehandlungen hervorgehoben.
In den letzten Jahren hat das Bewusstsein für die Resistenz gegen Pilzkrankheiten zugenommen, was zu einem vorsichtigeren Einsatz von Arzneimitteln wie Itraconazol geführt hat, um eine Resistenzentwicklung zu verhindern. Dies hat auch dazu geführt, dass im Land mehr Forschung und klinische Studien durchgeführt werden, um langfristige Behandlungsstrategien besser zu verstehen.
Dr. Jürgen Müller, ein angesehener Spezialist für Infektionskrankheiten in Berlin, hat die Vorteile von Itraconazol bei der Behandlung invasiver Pilzinfektionen, insbesondere bei immungeschwächten Patienten, erörtert. Er hebt häufig seine Rolle bei der Behandlung von Erkrankungen wie Aspergillose und Candidose hervor.
Verwendet
Itraconazol ist in Deutschland ein verschreibungspflichtiges Medikament. Es ist für Patienten nur auf ärztliche Verschreibung erhältlich, so dass eine ordnungsgemäße medizinische Überwachung seiner Anwendung gewährleistet ist.
Itraconazol-Kapseln zur intravenösen und oralen Verabreichung werden zur Behandlung systemischer Pilzinfektionen bei immungeschwächten und immunkompetenten Patienten eingesetzt. Dazu gehören die Blastomykose (pulmonal und extrapulmonal), die Histoplasmose (einschließlich der chronischen kavitären Lungenerkrankung und der disseminierten nichtmeningealen Erkrankung) und die Aspergillose (pulmonal und extrapulmonal bei Patienten, die auf Amphotericin B nicht ansprechen oder es nicht vertragen).
Itraconazol als orale Lösung (nicht aber Itraconazol-Kapseln) wird zur Behandlung der oropharyngealen und ösophagealen Candidose eingesetzt. Itraconazol (zunächst intravenös verabreicht, dann Itraconazol-Lösung zum Einnehmen) wird zur empirischen antimykotischen Therapie bei febrilen neutropenischen Patienten eingesetzt. Orale Itraconazol-Kapseln werden bei immunkompetenten Personen zur Behandlung der durch Dermatophyten verursachten Tinea unguium (Onychomykose) der Zehennägel und/oder Fingernägel eingesetzt.

Itraconazol wird auch oral zur Vorbeugung schwerer Pilzinfektionen (z. B. Kokzidioidomykose, Kryptokokkose, Histoplasmose, mukokutane Candidose) bei Patienten mit einer Infektion mit dem humanen Immundefizienz-Virus (HIV) eingesetzt. Vor Beginn einer Itraconazol-Infusion oder oralen Itraconazol-Kapseln zur Behandlung von systemischen Pilzinfektionen sollten geeignete Proben für Pilzkulturen und andere relevante Laboruntersuchungen (Nasspräparation, Histopathologie, Serologie) entnommen werden, um den/die verursachenden Organismus/e zu isolieren und zu identifizieren. Bis zum Vorliegen der Ergebnisse dieser In-vitro-Tests kann mit der Itraconazol-Therapie begonnen werden; sobald die Ergebnisse vorliegen, sollte die Therapie jedoch entsprechend angepasst werden. Vor Beginn der Behandlung der Onychomykose mit oralen Itraconazol-Kapseln sollten geeignete Nagelproben für mikrobiologische Untersuchungen (z. B. Kaliumhydroxid [KOH]-Präparat, Pilzkultur, Nagelbiopsie) zur Bestätigung der Diagnose entnommen werden.
Aspergillose
Itraconazol wird zur Behandlung der pulmonalen und extrapulmonalen Aspergillose bei Patienten eingesetzt, die IV-Amphotericin B nicht vertragen oder darauf refraktär sind. IV-Amphotericin B gilt im Allgemeinen als Behandlung der Wahl bei invasiver Aspergillose, insbesondere bei lebensbedrohlichen und schweren Infektionen, und Itraconazol ist eine Alternative. Bei einer begrenzten Anzahl von Patienten mit invasiver Aspergillose, die auf intravenöses Amphotericin B nicht ansprachen oder es nicht vertragen haben, haben sich orale Itraconazol-Kapseln (200-400 mg täglich über eine mittlere Therapiedauer von 3-4 Monaten) als Zweitlinientherapie bewährt.
Blastomykose
Itraconazol wird zur Behandlung der pulmonalen und extrapulmonalen Blastomykose eingesetzt, die durch Blastomyces dermatitidis verursacht wird. Während sowohl orale Itraconazol-Kapseln als auch intravenös verabreichtes Amphotericin B als Mittel der Wahl für die Behandlung der Blastomykose gelten, wird Amphotericin B für die Behandlung schwerer Infektionen bevorzugt, insbesondere wenn das ZNS betroffen ist. Auch für die Erstbehandlung einer vermuteten Blastomykose bei immungeschwächten Patienten, einschließlich HIV-Infizierten, wird in der Regel Amphotericin B intravenös eingesetzt. Viele Kliniker betrachten orales Itraconazol als Mittel der Wahl für die Behandlung nicht-meningealer, nicht lebensbedrohlicher Blastomykosen, einschließlich leichter bis mittelschwerer disseminierter Infektionen ohne ZNS-Beteiligung, und empfehlen das Medikament auch für die Folgebehandlung von Patienten mit schwereren Infektionen, nachdem ein erstes Ansprechen mit IV-Amphotericin B erzielt wurde.
Es wurde über Behandlungsmisserfolge berichtet, wenn ein orales Antimykotikum (z. B. Ketoconazol) zur Behandlung einer kutanen oder pulmonalen Blastomykose bei Patienten eingesetzt wurde, die zum Zeitpunkt der Erstdiagnose eine asymptomatische oder subklinische ZNS-Beteiligung aufwiesen. Dies sollte bei der Auswahl eines Antimykotikums für Blastomykose-Patienten berücksichtigt werden. Einige Kliniker sind der Meinung, dass Azol-Antimykotika nicht für die Erstbehandlung von Patienten mit ZNS-Blastomykose verwendet werden sollten.
Histoplasmose
Itraconazol wird zur Behandlung der Histoplasmose eingesetzt, einschließlich der chronischen kavitären Lungenerkrankung und der disseminierten nichtmeningealen Erkrankung. Sowohl intravenös verabreichtes Amphotericin B als auch orale Itraconazol-Kapseln gelten als Mittel der Wahl für die Behandlung der Histoplasmose. Für die Erstbehandlung einer schweren, lebensbedrohlichen Histoplasmose wird jedoch in der Regel intravenöses Amphotericin B bevorzugt, insbesondere bei immungeschwächten Patienten wie HIV-Infizierten.
Oral verabreichtes Itraconazol wird im Allgemeinen zur Erstbehandlung leichter bis mittelschwerer Infektionen (z. B. bei Patienten, die keinen Krankenhausaufenthalt benötigen) oder als Folgetherapie bei schweren Infektionen eingesetzt, nachdem ein Ansprechen auf Amphotericin B erzielt wurde.
Nach Angaben des Herstellers deuten die Daten einer begrenzten Anzahl von Patienten darauf hin, dass die Ansprechrate der Histoplasmose auf eine Itraconazol-Therapie bei HIV-Infizierten ähnlich hoch ist wie bei Patienten, die nicht mit diesem Virus infiziert sind. Allerdings ist der klinische Verlauf der Histoplasmose bei HIV-Infizierten im Allgemeinen schwerer und erfordert in der Regel eine langfristige Erhaltungstherapie, um einen Rückfall zu verhindern. Derzeit laufen Studien zur weiteren Ermittlung der Sicherheit und Wirksamkeit des Arzneimittels bei der Behandlung dieser Infektion bei HIV-Infizierten, einschließlich der Untersuchung der optimalen Dosierung und Dauer der Erhaltungstherapie. Orales Itraconazol gilt als Mittel der Wahl für die Primärprophylaxe und die langfristige Suppressions- oder Erhaltungstherapie (Sekundärprophylaxe) zur Verhinderung eines Wiederauftretens oder Rückfalls der Histoplasmose bei HIV-Infizierten. (Siehe Verwendung: Prävention von Pilzinfektionen bei HIV-Infizierten)
Oropharyngeale und ösophageale Candidiasis
Da die topischen Wirkungen und die Arzneimittelexposition bei der oralen Lösung größer sein können als bei Itraconazol-Kapseln, sollte zur Behandlung der oropharyngealen und ösophagealen Candidiasis nur die orale Itraconazol-Lösung verwendet werden. In 2 kontrollierten Studien an Patienten mit oropharyngealer Candidose (92 % waren HIV-infiziert) wurde bei 71-84 % der Patienten, die Itraconazol-Lösung zum Einnehmen erhielten, ein klinisches Ansprechen (definiert als Heilung oder Besserung) erreicht. Es gibt einige Hinweise darauf, dass Itraconazol-Lösung zum Einnehmen bei der Behandlung der oropharyngealen Candidose mindestens so wirksam ist wie orale Fluconazol-Tabletten und möglicherweise wirksamer als orale Clotrimazol-Lutschtabletten. Die orale Itraconazol-Lösung hat sich bei der Behandlung der oropharyngealen Candidose bei einigen Patienten, einschließlich einiger HIV-Infizierter, die auf orales Fluconazol nicht ansprachen, als wirksam erwiesen.
Sporotrichose
Dieses Medikament wird zur Behandlung von Sporotrichose eingesetzt. Während orales Itraconazol bei Patienten mit leichter bis mittelschwerer pulmonaler oder disseminierter Sporotrichose wirksam sein kann, ist intravenös verabreichtes Amphotericin B das Mittel der Wahl für die Erstbehandlung schwerer, lebensbedrohlicher Infektionen und immer dann, wenn eine Beteiligung des ZNS vorliegt. Orales Itraconazol gilt im Allgemeinen als Mittel der Wahl für die Behandlung der kutanen, lymphokutanen oder leichten pulmonalen oder osteoartikulären Sporotrichose und für die Folgetherapie bei schwereren Infektionen, nachdem ein Ansprechen mit IV-Amphotericin B erreicht wurde.
Da die Sporotrichose bei immungeschwächten Patienten (z. B. HIV-Infizierten) besonders aggressiv und schwer zu behandeln ist, ist IV-Amphotericin B wahrscheinlich das Mittel der Wahl für die Ersttherapie bei diesen Patienten; allerdings kommt es zu Behandlungsfehlern. Einige Ärzte empfehlen HIV-Infizierten, die wegen Sporotrichose behandelt wurden, eine lebenslange Suppressions- oder Erhaltungstherapie mit oralem Itraconazol, um einen Rückfall zu verhindern. Eine solche Prophylaxe wird in den aktuellen Richtlinien des US Public Health Service und der Infectious Diseases Society of America (USPHS/IDSA) zur Prävention opportunistischer Infektionen bei HIV-Infizierten nicht behandelt.
Onychomykose
Orale Itraconazol-Kapseln werden bei immunkompetenten Personen zur Behandlung von Onychomykose der Zehennägel (mit oder ohne Beteiligung der Fingernägel) und Onychomykose der Fingernägel, die durch Dermatophyten (Tinea unguium) verursacht wird, eingesetzt.
Vor der Verabreichung von Itraconazol-Kapseln zur Behandlung von Onychomykose sollten geeignete Nagelproben für mikrobiologische Untersuchungen (z. B. Kaliumhydroxid [KOH]-Präparat, Pilzkultur, Nagelbiopsie) zur Bestätigung der Diagnose entnommen werden. In doppelblinden, placebokontrollierten Studien an Patienten mit Onychomykose der Zehennägel führte orales Itraconazol (200 mg als Kapseln, die einmal täglich über 12 aufeinander folgende Wochen verabreicht wurden) bei 54 % der Patienten zu einer mykologischen Heilung; bei 35 % wurde ein Gesamterfolg erzielt (mykologische Heilung plus klare oder minimale Nagelbeteiligung mit deutlich verringerten Anzeichen) und bei 14 % kam es zu einer mykologischen Heilung plus klinischer Heilung (Beseitigung aller Anzeichen, mit oder ohne verbleibende Nageldeformität).
Die durchschnittliche Zeit bis zum Gesamterfolg betrug etwa 10 Monate; bei 21 % der als Gesamterfolg eingestuften Patienten kam es jedoch zu einem Rückfall der Onychomykose. In einer doppelblinden, placebokontrollierten Studie an Patienten mit Onychomykose der Fingernägel führte die orale Verabreichung von Itraconazol in einem pulsierenden Dosierungsschema (200 mg als Kapseln zweimal täglich in der ersten Woche, kein Itraconazol in den Wochen 2 bis 4 und 200 mg als Kapseln zweimal täglich in der fünften Woche) bei 61 % der Patienten zu einer mykologischen Heilung; 56 % wurden als Gesamterfolg eingestuft und 47 % hatten eine mykologische Heilung plus klinische Heilung. Die durchschnittliche Zeit bis zum Gesamterfolg betrug etwa 5 Monate; bei den Patienten, die als Gesamterfolg eingestuft wurden, traten keine Rückfälle auf.
Paracoccidioidomykose
Orale Itraconazol-Kapseln werden zur Behandlung der Paracoccidioidomykose (südamerikanische Blastomykose) eingesetzt, die durch Paracoccidioides brasiliensis verursacht wird, und gelten als Mittel der Wahl zur Behandlung dieser Infektion. Obwohl das wirksamste Therapieschema für die Behandlung der Paracoccidioidomykose bei HIV-Infizierten noch nicht ermittelt wurde, schlagen einige Ärzte vor, dass diese Patienten zunächst mit Amphotericin B intravenös behandelt werden und dann ein weniger toxisches Mittel (z. B, oral verabreichte Itraconazol-Kapseln, Co-Trimoxazol) für eine langfristige Suppressionstherapie zur Prophylaxe eines erneuten Auftretens oder eines Rückfalls verwendet werden kann; eine solche Prophylaxe wird in den aktuellen Leitlinien, die von der USPHS/IDSA zur Prävention opportunistischer Infektionen bei HIV-Infizierten empfohlen werden, nicht behandelt.
Kokzidioidomykose und Kryptokokkose
Obwohl sie nicht als Mittel der ersten Wahl gelten, werden orale Itraconazol-Kapseln als alternatives Mittel zur Behandlung von Kokzidioidomykose oder Kryptokokkose eingesetzt. Itraconazol-Kapseln werden auch als alternatives Mittel zur Primärprophylaxe der Kryptokokkose oder zur Suppressiv- oder Erhaltungstherapie eingesetzt, um ein Wiederauftreten oder einen Rückfall der Kokzidioidomykose oder Kryptokokkose bei HIV-infizierten Personen zu verhindern.
Chromomykose
Orale Itraconazol-Kapseln wurden mit einigem Erfolg zur Behandlung der Chromomykose (Chromoblastomykose) eingesetzt, die durch verschiedene Dematiaceen-Pilze (z. B. Cladosporium, Exophiala, Fonsecaea, Phialophora) verursacht wird.
Basidiobolomykose
Orales Itraconazol wurde bei einer begrenzten Anzahl von Patienten zur Behandlung der gastrointestinalen Basidiobolomykose eingesetzt, einer durch Basidiobolus ranarum verursachten Zygomykose. B. ranarum wurde weltweit aus verrottender Vegetation und Erde sowie aus dem Magen-Darm-Trakt von Reptilien, Amphibien, Fischen und insektenfressenden Fledermäusen (auch in den USA) isoliert. Die Basidiobolomykose tritt am häufigsten in tropischen und subtropischen Regionen wie Ost- und Westafrika auf, und die Infektion äußert sich in der Regel als schmerzlose, subkutane Knötchen an den Gliedmaßen, am Rumpf oder am Gesäß als Folge einer traumatischen Inokulation.
Infektionen des Magen-Darm-Trakts sind extrem selten und möglicherweise die Folge der Aufnahme von kontaminierter Erde (insbesondere in der Nähe von Flüssen oder Seen) oder von Obst oder Gemüse, das mit Erde oder Kot von infizierten Reptilien oder Amphibien verunreinigt ist. Von April 1994 bis Mai 1999 wurden in Arizona 7 Fälle von Basidiobolomykose des Magen-Darm-Trakts festgestellt. Die meisten Fälle von Basidiobolomykose des Magen-Darm-Trakts wurden nach einer chirurgischen Teilresektion des Magen-Darm-Trakts erfolgreich mit oralem Itraconazol (400 mg täglich über einen Zeitraum von 3-19 Monaten) behandelt; es ist jedoch unklar, ob eine klinische Reaktion erzielt worden wäre, wenn Itraconazol allein ohne chirurgischen Eingriff eingesetzt worden wäre. Obwohl auch Ketoconazol bei mindestens einem Patienten wirksam war, hat sich Amphotericin B bei mehreren Patienten als unwirksam für die Behandlung der Basidiobolomykose des Magen-Darm-Trakts erwiesen.
Empirische Therapie bei fiebrig-neutropenischen Patienten
Itraconazol (zunächst intravenös verabreicht, dann als orale Lösung) wird für die empirische Therapie von vermuteten Pilzinfektionen bei febrilen neutropenischen Patienten eingesetzt. Die Sicherheit und Wirksamkeit von Itraconazol für diese Indikation wurde in einer offenen, randomisierten Studie bei febrilen neutropenischen Erwachsenen mit hämatologischen Malignomen untersucht; die Patienten erhielten entweder Itraconazol (200 mg IV zweimal täglich für 2 Tage, dann 200 mg IV einmal täglich von Tag 3-14, gefolgt von Itraconazol als orale Lösung, 200 mg zweimal täglich, um die Therapie bis zu 28 Tage lang abzuschließen) oder herkömmliches IV-Amphotericin B (0,7-1 mg/kg täglich für bis zu 28 Tage). Die therapeutische Erfolgsrate (definiert als Überleben der Patienten mit Abklingen von Fieber und Neutropenie innerhalb von 28 Tagen nach Beginn der Therapie, Fehlen neu auftretender Pilzinfektionen, Verwendung des Studienmedikaments ohne vorzeitigen Abbruch aufgrund von Toxizität oder mangelnder Wirksamkeit und Therapie über 3 oder mehr Tage) betrug 47 % für Itraconazol und 38 % für Amphotericin B (Intent-to-treat-Analyse). Obwohl die Gesamtansprechrate bei den mit Itraconazol behandelten Patienten höher war, brachen mehr Patienten, die Itraconazol erhielten, das Medikament wegen anhaltenden Fiebers ab oder wechselten wegen Fiebers die antimykotische Therapie, und mehr Patienten, die Amphotericin B erhielten, brachen das Medikament wegen Unverträglichkeit ab.
Prävention von Pilzinfektionen bei HIV-infizierten Personen
Orales Itraconazol wird bei ausgewählten Patienten mit HIV-Infektion zur Primärprophylaxe gegen Kryptokokkose oder Histoplasmose und zur langfristigen Suppressions- oder Erhaltungstherapie (Sekundärprophylaxe) eingesetzt, um ein Wiederauftreten oder einen Rückfall von Kokzidioidomykose, Kryptokokkose, Histoplasmose oder mukokutaner Candidose zu verhindern.
Die Arbeitsgruppe für die Prävention von opportunistischen Infektionen der USPHS/IDSA hat Leitlinien für die Prävention von opportunistischen Infektionen, einschließlich Pilzinfektionen, bei HIV-Infizierten erstellt. Diese Leitlinien enthalten Empfehlungen zur Prävention der Exposition gegenüber opportunistischen Erregern, zur Vorbeugung erster Krankheitsschübe und zur Vorbeugung des Wiederauftretens von Krankheiten. Die USPHS/IDSA stellt fest, dass eine Primärprophylaxe zur Verhinderung der ersten Episoden einer mukokutanen Candidose bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen und Kindern nicht empfohlen wird.
Während eine routinemäßige Primärprophylaxe zur Vorbeugung erster Episoden von Kokzidioidomykose, Kryptokokkose oder Histoplasmose bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen und Kindern nicht empfohlen wird, stellt die USPHS/IDSA fest, dass eine Primärprophylaxe gegen Kryptokokkose oder Histoplasmose bei bestimmten ausgewählten Personen in Betracht gezogen werden kann. Die USPHS/IDSA empfiehlt, dass HIV-infizierte Erwachsene, Jugendliche, Säuglinge und Kinder, die die Ersttherapie einer nachgewiesenen Kokzidioidomykose, Kryptokokkose oder Histoplasmose abgeschlossen haben, eine langfristige Suppressiv- oder Erhaltungstherapie (Sekundärprophylaxe) erhalten, um ein Wiederauftreten oder einen Rückfall dieser Pilzinfektionen zu verhindern.
Darüber hinaus stellt die USPHS/IDSA fest, dass HIV-infizierte Personen, bei denen es zu häufigen oder schweren Rückfällen einer mukokutanen Candidose kommt, von einer langfristigen Suppressions- oder Erhaltungstherapie (Sekundärprophylaxe) profitieren können. Aufgrund von Bedenken hinsichtlich der Anwendung von oralen Azol-Antimykotika während der Schwangerschaft sollte Itraconazol nicht zur Primärprophylaxe oder zur chronischen Suppressions- oder Erhaltungstherapie bei schwangeren Frauen eingesetzt werden. Wenn eine Frau schwanger wird, während sie Itraconazol zur Prophylaxe erhält, und sich entscheidet, die Schwangerschaft fortzusetzen, sollte das Arzneimittel abgesetzt werden.
Wirksame empfängnisverhütende Maßnahmen werden für alle HIV-infizierten Frauen empfohlen, die ein orales Azol-Antimykotikum zur Suppressivtherapie erhalten. Konventionelles IV-Amphotericin B kann das bevorzugte Mittel sein, wenn eine langfristige Suppressions- oder Erhaltungstherapie gegen Kokzidioidomykose, Kryptokokkose oder Histoplasmose bei einer HIV-infizierten Schwangeren angezeigt ist, insbesondere während des ersten Trimesters.
Primäre Prophylaxe
Die Sicherheit und Wirksamkeit von oralem Itraconazol zur Primärprophylaxe von schweren Pilzinfektionen bei HIV-Infizierten wurde in einer prospektiven, randomisierten, placebokontrollierten Studie an 149 Patienten mit fortgeschrittener HIV-Infektion untersucht. Bei 19 % der Patienten, die orales Itraconazol (200 mg einmal täglich) erhielten, und 29 % der Patienten, die Placebo erhielten, versagte die Prophylaxe. Ein Versagen der Prophylaxe im Zusammenhang mit invasiven Pilzinfektionen (Histoplasmose, Kryptokokkose, Aspergillose) war bei den mit Placebo behandelten Patienten häufiger als bei den mit Itraconazol behandelten; die Häufigkeit des Versagens der Prophylaxe aufgrund rezidivierender oder refraktärer Schleimhautcandidosen war jedoch in beiden Gruppen ähnlich. Während die Itraconazol-Prophylaxe die Zeit bis zum Auftreten von Histoplasmose und Kryptokokkose signifikant verzögerte, konnte ein Überlebensvorteil bei denjenigen, die das Medikament erhielten, nicht nachgewiesen werden.
Kryptokokkose
Laut USPHS/IDSA wird eine routinemäßige Primärprophylaxe gegen Kryptokokkose zwar nicht empfohlen, doch kann eine Primärprophylaxe bei HIV-infizierten Erwachsenen und Jugendlichen mit einer CD4-T-Zellzahl von weniger als 50/mm3 sowie bei Säuglingen und Kindern mit schwerer Immunsuppression (gemäß den altersangepassten Kriterien) in Betracht gezogen werden. Eine routinemäßige Prophylaxe wird nicht empfohlen, da Kryptokokken-Erkrankungen relativ selten auftreten, ein Überlebensvorteil im Zusammenhang mit der Prophylaxe nicht nachgewiesen werden konnte und auch andere Bedenken bestehen (z. B. mögliche Wechselwirkungen mit anderen Medikamenten, potenzielle Resistenzentwicklung, Kostenerwägungen).
Die Notwendigkeit einer Primärprophylaxe oder Suppressionstherapie gegen andere Pilzinfektionen (z. B. Kokzidioidomykose, Histoplasmose, mukokutane Candidose) sollte bei der Entscheidung über eine Prophylaxe gegen Kryptokokkose berücksichtigt werden. Eine routinemäßige Untersuchung asymptomatischer Personen auf Kryptokokken-Antigen im Serum wird nicht empfohlen, da die Wahrscheinlichkeit, dass die Ergebnisse klinische Entscheidungen beeinflussen, gering ist. HIV-Infizierte können die Exposition gegenüber Cryptococcus neoformans nicht vollständig vermeiden; es gibt keine Hinweise darauf, dass die Exposition gegenüber Taubenkot mit einem erhöhten Risiko für Kryptokokkose verbunden ist. Orales Fluconazol ist das Mittel der Wahl für die Primärprophylaxe der Kryptokokkose bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen und Kindern, und orales Itraconazol (in Kapselform) gilt als Alternative.
Histoplasmose
Laut USPHS/IDSA kann eine Primärprophylaxe gegen Histoplasmose bei HIV-infizierten Erwachsenen oder Jugendlichen mit absoluten Helfer-/Induktor-T-Zellen (CD4 , T4 ) T-Zellzahlen unter 100/mm3, die aufgrund beruflicher Exposition einem besonders hohen Risiko einer Exposition gegenüber Histoplasma capsulatum ausgesetzt sind oder die in einer Gemeinde mit einer hyperendemischen Histoplasmoserate (mindestens 10 Fälle/100 Patientenjahre) leben, in Betracht gezogen werden kann.
Bei der Entscheidung, ob bei diesen HIV-Infizierten eine Primärprophylaxe gegen Histoplasmose eingesetzt werden soll, sollten die Ärzte die lokale Inzidenz der Histoplasmose, die Möglichkeit von Arzneimittelwechselwirkungen, die Toxizität, die Entwicklung von Resistenzen, die Kosten und die Notwendigkeit einer Prophylaxe gegen andere Pilzinfektionen (z. B. Candidose, Kryptokokkose) berücksichtigen.
Ein routinemäßiger Hauttest mit Histoplasmin oder ein serologischer Test auf Histoplasmose-Antikörper oder -Antigene bei HIV-Infizierten, die in endemischen Gebieten leben, ist nicht prädiktiv für eine Erkrankung und wird nicht empfohlen. Obwohl HIV-Infizierte, die in Histoplasmose-Endemiegebieten leben oder diese besuchen, die Exposition gegenüber H. capsulatum nicht vollständig vermeiden können, sollten Personen mit einer CD4-T-Zellzahl von weniger als 200/mm3 Tätigkeiten vermeiden, von denen bekannt ist, dass sie mit einem erhöhten Risiko verbunden sind (z. B. Staubaufwirbelung bei der Arbeit an der Oberfläche; Reinigung von Hühnerställen, die stark mit Exkrementen kontaminiert sind; Aufwirbeln von Erde unter Vogel-Nistplätzen; Reinigung, Umbau oder Abriss alter Gebäude; Erkundung von Höhlen). Orales Itraconazol (in Form von Kapseln) ist das Mittel der Wahl für die Primärprophylaxe gegen Histoplasmose bei HIV-infizierten Erwachsenen, Jugendlichen oder pädiatrischen Patienten; die USPHS/IDSA gibt keine Empfehlung für eine Alternative zu Itraconazol.
Vorbeugung von Rezidiven
Kokzidioidomykose: Für eine langfristige Suppressiv- oder Erhaltungstherapie (Sekundärprophylaxe) zur Verhinderung eines erneuten Auftretens oder eines Rückfalls bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen und Kindern mit nachgewiesener Kokzidioidomykose, die angemessen behandelt wurde, empfiehlt die USPHS/IDSA orales Fluconazol als Mittel der Wahl und IV-Amphotericin B oder orales Itraconazol (als Kapseln verabreicht) als Alternativen. Die langfristige Suppressiv- oder Erhaltungstherapie zur Prophylaxe eines erneuten Auftretens oder eines Rückfalls der Kokzidioidomykose bei HIV-Infizierten wird im Allgemeinen lebenslang fortgesetzt. Obwohl bei HIV-Infizierten, die eine antimykotische Suppressionsprophylaxe gegen Kokzidioidomykose erhalten, ein geringes Risiko für ein Wiederauftreten dieser Pilzinfektion bestehen kann, wenn ihre CD4-T-Zellzahl auf über 100/mm3 ansteigt, während sie eine wirksame antiretrovirale Kombinationstherapie erhalten, stellt die USPHS/IDSA fest, dass die bisherigen Daten nicht ausreichen, um eine Empfehlung zum Absetzen der Prophylaxe bei diesen Personen zu rechtfertigen.
Kryptokokkose: Für eine langfristige Suppressiv- oder Erhaltungstherapie (Sekundärprophylaxe) zur Verhinderung eines erneuten Auftretens oder eines Rückfalls bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen und Kindern mit nachgewiesener Kryptokokkose, die angemessen behandelt wurde, empfiehlt die USPHS/IDSA orales Fluconazol als Mittel der Wahl und als Alternativen intravenöses Amphotericin B oder orales Itraconazol (in Kapselform).
Die Suppressiv- oder Erhaltungstherapie (Sekundärprophylaxe) zur Verhinderung eines Wiederauftretens oder eines Rückfalls der Kryptokokkose bei HIV-Infizierten wird im Allgemeinen lebenslang fortgesetzt, es sei denn, das Immunsystem hat sich durch eine starke antiretrovirale Therapie erholt.
Histoplasmose: Für eine langfristige Suppressiv- oder Erhaltungstherapie zur Verhinderung eines erneuten Auftretens oder eines Rückfalls bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen und Kindern mit nachgewiesener Histoplasmose, die angemessen behandelt wurde, empfiehlt die USPHS/IDSA orales Itraconazol (in Form von Kapseln) als Mittel der Wahl und als Alternative IV-Amphotericin B. Die langfristige Suppressions- oder Erhaltungstherapie gegen Histoplasmose bei HIV-Infizierten wird im Allgemeinen lebenslang fortgesetzt. Obwohl bei Patienten, die eine antimykotische Suppressionsprophylaxe erhalten, ein geringes Risiko für ein Wiederauftreten der Histoplasmose besteht, wenn ihre CD4-T-Zellzahl auf über 100/mm3 ansteigt, während sie eine starke antiretrovirale Kombinationstherapie erhalten, stellt die USPHS/IDSA fest, dass die bisherigen Daten nicht ausreichen, um eine Empfehlung für das Absetzen der Prophylaxe bei diesen Personen zu rechtfertigen.
Mukokutane Candidiasis: Die USPHS/IDSA empfiehlt eine langfristige Suppressions- oder Erhaltungstherapie für Erwachsene und Jugendliche mit einer dokumentierten Ösophaguscandidose in der Vorgeschichte (insbesondere bei mehreren Episoden), wobei das Potenzial für die Entwicklung resistenter Candida-Stämme zu berücksichtigen ist. Darüber hinaus empfiehlt die USPHS/IDSA eine Suppressionstherapie für Säuglinge und Kinder mit schwerer, wiederkehrender mukokutaner Candidose, insbesondere mit ösophagealer Candidose.
Obwohl viele Experten keine Langzeit-Suppressionstherapie bei rezidivierender oropharyngealer oder vulvovaginaler Candidose empfehlen, raten sie aus den gleichen Gründen von einer Primärprophylaxe gegen Candidose ab. Die USPHS/IDSA erklärt, dass eine Suppressionstherapie gegen Candidose bei HIV-infizierten Personen mit häufigen oder schweren Rückfällen dieser Infektionen in Betracht gezogen werden kann.
Bei der Erwägung einer solchen Therapie sollten jedoch mehrere Faktoren berücksichtigt werden, darunter die Auswirkungen der Rezidive auf das Wohlbefinden und die Lebensqualität des Patienten, die Notwendigkeit einer Prophylaxe gegen andere Pilzinfektionen, die Kosten der Prophylaxe, Arzneimitteltoxizitäten, Arzneimittelwechselwirkungen und das Potenzial für die Entwicklung einer Arzneimittelresistenz bei Candida und anderen Pilzen. Wenn eine langfristige Suppressions- oder Erhaltungstherapie bei HIV-infizierten Erwachsenen, Jugendlichen, Säuglingen oder Kindern mit häufigen oder schwerwiegenden Rezidiven einer oropharyngealen, ösophagealen oder vaginalen Candidiasis angezeigt ist, empfiehlt die USPHS/IDSA orales Fluconazol als Mittel der Wahl und Itraconazol (als orale Lösung verabreicht) als Alternative.
Verabreichung
Itraconazol wird oral oder als intravenöse Infusion verabreicht.
Itraconazol ist in Deutschland in Form von oralen Kapseln und oraler Lösung erhältlich. Die üblichen Dosierungen sind 100-mg- und 200-mg-Kapseln, die in der Regel ein- oder zweimal täglich eingenommen werden, je nach der zu behandelnden Erkrankung. Die orale Lösung wird in der Regel in einer Konzentration von 10 mg/ml verschrieben.
Orale Verabreichung
Die Bioverfügbarkeit von oral verabreichtem Itraconazol hängt davon ab, ob das Arzneimittel in Form von Kapseln oder als orale Lösung verabreicht wird, und der Hersteller weist darauf hin, dass diese Präparate nicht austauschbar verwendet werden sollten. Die orale Itraconazol-Lösung (nicht die Itraconazol-Kapseln) ist für die Behandlung der oropharyngealen oder ösophagealen Candidiasis angezeigt. Während Itraconazol-Lösung zum Einnehmen möglichst ohne Nahrung verabreicht werden sollte, sollten Itraconazol-Kapseln mit einer vollständigen Mahlzeit eingenommen werden, um eine maximale Aufnahme des Arzneimittels zu gewährleisten. Die Möglichkeit, dass die Resorption des Arzneimittels im Magen-Darm-Trakt bei Patienten mit Hypochlorhydrie, über die bei HIV-Infizierten berichtet wurde, verringert sein kann, sollte in Betracht gezogen werden.
IV-Infusion
Die im Handel erhältliche Itraconazol-Injektion muss vor der intravenösen Infusion verdünnt werden. Der gesamte Inhalt einer Ampulle mit Itraconazol-Injektion (250 mg) sollte zu dem vom Hersteller bereitgestellten 0,9%igen Natriumchlorid-Injektionsverdünnungsmittel (50 ml) hinzugefügt werden, um eine Lösung mit einem Gehalt von 3,33 mg/ml in einem resultierenden Volumen von 75 ml zu erhalten.
Um eine maximale Sicherheit und Wirksamkeit zu gewährleisten, muss die Itraconazol-Lösung korrekt zubereitet und verabreicht werden. Es ist das richtige Verhältnis von Itraconazol zu Verdünnungsmittel zu verwenden und eine Endkonzentration von 3,33 mg/ml aufrechtzuerhalten, um eine stabile Mischung zu gewährleisten und die Bildung eines Präzipitats zu vermeiden.
Wenn die Lösung und der Behälter es zulassen, sollten Itraconazol-Injektionen und verdünnte Lösungen des Arzneimittels vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden. Um eine 200-mg-Dosis Itraconazol zu verabreichen, sollte die verdünnte Lösung vorsichtig gemischt werden, und dann sollten 15 ml entnommen und verworfen werden. Die verbleibenden 60 ml der verdünnten Lösung, die 3,33 mg/ml enthält, sollten als intravenöse Infusion über 60 Minuten verabreicht werden.
Die Infusion sollte unter Verwendung eines kontrollierten Infusionsgeräts, des vom Hersteller bereitgestellten Infusionssets und einer speziellen Infusionsleitung erfolgen. Itraconazol darf nicht mit anderen Arzneimitteln gemischt werden und sollte nicht über dieselbe Infusionsleitung wie andere Arzneimittel verabreicht werden. Nach Beendigung der Infusion empfiehlt der Hersteller, das Infusionsset über den 2-Wege-Hahn mit 15-20 ml einer 0,9%igen Natriumchlorid-Injektion über 30 Sekunden bis 15 Minuten zu spülen; anschließend sollte die gesamte Infusionsleitung entsorgt werden. Bakteriostatische Natriumchloridlösung sollte nicht als Spüllösung verwendet werden, da die Kompatibilität von Itraconazol-Lösung mit anderen Spüllösungen als 0,9%igem Natriumchlorid nicht bekannt ist.
Dosierung
Aufgrund von Unterschieden in der oralen Bioverfügbarkeit sollten Itraconazol-Kapseln und orale Lösung nicht auf einer mg-für-mg-Basis austauschbar verwendet werden.
Die Dosierung von Itraconazol-Kapseln sollte sich nach Art und Schwere der Infektion, der Identität des verursachenden Organismus und dem Ansprechen des Patienten auf die Therapie richten. Das Medikament scheint in der Leber einen sättigbaren Metabolismus zu durchlaufen; daher können Dosiserhöhungen zu einem überproportionalen Anstieg der Plasmakonzentrationen führen.
Zur Behandlung von lebensbedrohlichen systemischen Pilzinfektionen sollte Itraconazol intravenös oder in Form von oralen Itraconazol-Kapseln verabreicht werden, wobei eine Anfangsdosis zu verwenden ist. Bei anfänglicher intravenöser Verabreichung von Itraconazol beträgt die empfohlene Ladedosis bei Erwachsenen 200 mg intravenös zweimal täglich über 4 aufeinanderfolgende Dosen, gefolgt von 200 mg einmal täglich in der Folge.
Obwohl in klinischen Studien zur Bewertung der Sicherheit und Wirksamkeit von oralen Itraconazol-Kapseln keine Ladedosis verwendet wurde, geben der Hersteller und einige Kliniker aufgrund pharmakokinetischer Überlegungen an, dass orale Itraconazol-Kapseln bei lebensbedrohlichen Infektionen bei Erwachsenen mit einer anfänglichen Ladedosis von 200 mg dreimal täglich (600 mg täglich) während der ersten drei bis vier Tage der Therapie begonnen werden sollten. Die anschließende Therapie kann dann mit der üblichen oralen Dosierung von 200-400 mg täglich fortgesetzt werden.
Der Hersteller gibt an, dass die Itraconazol-Therapie mindestens drei Monate lang fortgesetzt werden sollte, bis die klinischen Parameter und Labortests zeigen, dass die aktive Pilzinfektion abgeklungen ist. Einige Kliniker sind der Ansicht, dass die optimale Therapiedauer für schwere Pilzinfektionen zwar noch nicht feststeht, die Itraconazol-Therapie bei disseminierter oder chronischer pulmonaler Histoplasmose jedoch wahrscheinlich mindestens 12 Monate und bei Blastomykose 6-12 Monate fortgesetzt werden sollte. Eine unzureichende Behandlungsdauer kann zu einem Wiederauftreten der aktiven Infektion führen.
| Zustand | Dosierung | Art der Verabreichung | Dauer |
|---|---|---|---|
| Pulmonale/Extrapulmonale Aspergillose | 200-400 mg täglich; bei invasiven Fällen können höhere Dosen (bis zu 600 mg) verwendet werden | Oral/IV | IV: 200 mg zweimal täglich für 4 Dosen, dann 200 mg einmal täglich; Oral: nach Bedarf |
| Blastomykose/Histoplasmose | Initial: 200 mg einmal täglich; Erhöhung in 100-mg-Schritten auf maximal 400 mg täglich | Oral/IV | Mindestens 6 Monate bei Blastomykose; 12-24 Monate bei chronischer Histoplasmose |
| Oropharyngeale Candidiasis | 100 mg/Tag bei nicht-kompromittierten Patienten; 200-400 mg/Tag bei neutropenischen Patienten | Orale Lösung | Mindestens 3 Wochen |
| Ösophagus-Candidose | 100 mg (10 mL) täglich, kann je nach Ansprechen auf 200 mg (20 mL) täglich erhöht werden | Orale Lösung | Mindestens 3 Wochen |
| Vaginale Candidose | Zwei Dosen von 200 mg im Abstand von 6-8 Stunden | Zum Einnehmen | Behandlung an einem Tag |
| Sporotrichose | 100-200 mg einmal täglich bei kutanen Infektionen; 200 mg zweimal täglich bei osteoartikulären | Oral | 3-6 Monate für kutane Infektionen; 12 Monate für osteoartikuläre Infektionen |
| Onychomykose | 200 mg einmal täglich für Zehennägel (12 Wochen); Impulsdosierung von 400 mg einmal täglich für eine Woche jeden Monat für 3 Monate | Oral | Variiert je nach Schema |
| Empirische Therapie bei fiebrig-neutropenischen Patienten | IV: 200 mg zweimal täglich für 4 Dosen, dann Reduzierung auf 200 mg einmal täglich; oral: 200 mg (20 ml) zweimal täglich bis zur Genesung | IV/oral | Bis zu 14 Tage IV, dann oral bis zur Genesung |
| Kutane Dermatophytosen | 100 mg/Tag | Oral | Tinea corporis/cruris: 2 Wochen; Tinea pedis/manuum: 4 Wochen |
| Pityriasis versicolor | 200 mg/Tag | Zum Einnehmen | 1 Woche |
| Subkutane/tiefe Pilzinfektion | 200-400 mg/Tag; bei lebensbedrohlichen Infektionen können Aufnahmemengen von bis zu 600 mg/Tag verwendet werden | Oral | Fortlaufend nach Bedarf |
| Langfristige Erhaltungstherapie bei AIDS-Patienten | Histoplasmose/Kryptokokkose: 200 mg/Tag; neutropenische Patienten: 400 mg/Tag | Oral |
Im Allgemeinen lebenslang fortgesetzt
|
Prävention von Pilzinfektionen bei HIV-infizierten Personen
| Zustand | Dosierung | Art der Verabreichung | Dauer |
|---|---|---|---|
| Primäre Prophylaxe gegen Kryptokokkose | Erwachsene/Jugendliche: 200 mg einmal täglich; Säuglinge/Kinder: 2-5 mg/kg alle 12-24 Stunden | Oral | Fortlaufend nach Bedarf |
| Primärprophylaxe gegen Histoplasmose | Erwachsene/Heranwachsende: 200 mg einmal täglich; Säuglinge/Kinder: 2-5 mg/kg alle 12-24 Stunden | Oral | Fortlaufend nach Bedarf |
| Sekundärprophylaxe für Kokzidioidomykose | Erwachsene/Heranwachsende: 200 mg zweimal täglich; Säuglinge/Kinder: 2-5 mg/kg alle 12-48 Stunden | Oral | Im Allgemeinen lebenslang fortgesetzt |
| Sekundärprophylaxe der Histoplasmose | Erwachsene/Heranwachsende: 200 mg zweimal täglich; Säuglinge/Kinder: 2-5 mg/kg alle 12-48 Stunden | Oral | Im Allgemeinen lebenslang fortgesetzt |
| Sekundärprophylaxe für Kryptokokkose | Erwachsene/Heranwachsende: 200 mg einmal täglich; Säuglinge/Kinder: 2-5 mg/kg alle 12-24 Stunden | Oral | Im Allgemeinen lebenslang fortgesetzt |
| Sekundärprophylaxe bei mukokutaner Candidose | Erwachsene/Heranwachsende: 200 mg einmal täglich; Säuglinge/Kinder: 5 mg/kg einmal täglich | Orale Lösung | Im Allgemeinen lebenslang fortgesetzt |
Dosierung bei Nieren- und Leberinsuffizienz
Eine Anpassung der oralen Itraconazol-Dosierung bei Patienten mit eingeschränkter Nierenfunktion erscheint nicht erforderlich. Itraconazol-Injektion sollte nicht an Patienten mit eingeschränkter Nierenfunktion (d.h. Kreatinin-Clearance unter 30 ml/Minute) verabreicht werden, da eine schwere Nierenfunktionsstörung die Clearance von Hydroxypropyl-b-Cyclodextrin (einem Hilfsstoff in Itraconazol-Injektion) verringert.
Obwohl die Auswirkungen von Leberfunktionsstörungen auf die Pharmakokinetik von Itraconazol noch nicht geklärt sind, weist der Hersteller darauf hin, dass die Plasmakonzentrationen des Arzneimittels bei Patienten mit solchen Störungen sorgfältig überwacht werden sollten.
Im Vereinigten Königreich ist Itraconazol oral liquid zur Behandlung von oraler und ösophagealer Candidose in einer Dosis von 200 mg täglich über eine Woche zugelassen. Es kann als einmalige Tagesdosis oder vorzugsweise in zwei geteilten Dosen eingenommen werden, wobei die Flüssigkeit vor dem Schlucken 20 Sekunden lang im Mund behalten werden sollte. Zeigt sich nach einer Woche keine Reaktion, kann die Behandlung für eine weitere Woche fortgesetzt werden.
In den USA ist ein ähnliches Schema für die oropharyngeale Candidose zugelassen, aber für die ösophageale Candidose wird ein alternatives Schema von 100 mg täglich über mindestens drei Wochen bevorzugt, obwohl die Dosis bei Bedarf auf 200 mg täglich erhöht werden kann.
Einige Behörden in den USA, wie die Centers for Disease Control and Prevention, empfehlen eine höhere Dosis. Itraconazol kann auch als intravenöse Infusion verabreicht werden, und zwar in einer Dosis von 200 mg zweimal täglich über eine Stunde für zwei Tage, danach 200 mg täglich.
Hohe Dosen
Bei 8 Patienten mit systemischen Mykosen, die gegen die herkömmliche Therapie resistent waren, wurden Itraconazol-Dosen von 600 mg täglich in zwei geteilten Dosen über 3 bis 16 Monate angewendet. Zwei Patienten mit AIDS und Kryptokokkenmeningitis sprachen nicht auf die Behandlung an, und zwei Patienten, die zunächst auf die Behandlung ansprachen, erlitten später einen Rückfall oder entwickelten eine fortschreitende Erkrankung, als die Dosis reduziert wurde. Die wichtigsten unerwünschten Wirkungen waren Hypokaliämie, Bluthochdruck und Ödeme, möglicherweise in Verbindung mit einer Unterdrückung der Nebennierenfunktion. Bei einem Patienten mit zerebraler Aspergillose führte Itraconazol 800 mg täglich für 5 Monate und dann 400 mg täglich für weitere 4 Monate zu einem vollständigen Verschwinden der zerebralen Läsionen.
Verabreichung bei Kindern
| Indikation | Altersgruppe | Dosierung | Dauer |
|---|---|---|---|
| Tinea Capitis | Kinder < 20 kg | 50 mg täglich durch den Mund | Wie verordnet |
| Kinder ≥ 20 kg | 100 mg täglich durch den Mund | Wie vorgeschrieben | |
| Oropharyngeale Candidiasis | 1 Monat bis 12 Jahre | 3 bis 5 mg/kg (maximal 100 mg) täglich | 15 Tage |
| 12 bis 18 Jahre | 100 mg (200 mg bei Neutropenie oder AIDS) täglich | 15 Tage | |
| Dermatophyten-Infektionen | 1 Monat bis 12 Jahre | 3 bis 5 mg/kg täglich (maximal 200 mg bei Pityriasis versicolor, maximal 100 mg bei Tinea corporis, cruris, pedis, manuum) | Unterschiedlich (7-30 Tage, je nach Art der Infektion) |
| 12 bis 18 Jahre | 200 mg täglich für Pityriasis versicolor; 100 mg täglich für Tinea corporis und cruris; 100 mg täglich oder 200 mg zweimal täglich für Tinea pedis und manuum | Unterschiedlich (7-30 Tage, je nach Art der Infektion) | |
| Onychomykose | 1 bis 12 Jahre | Kurse von 5 mg/kg täglich für Fingernägel (2 Kurse) und Zehennägel (3 Kurse) | Wiederholung in Abständen von 21 Tagen |
| 12 bis 18 Jahre | Entweder 200 mg täglich für 3 Monate oder Kurse von 200 mg zweimal täglich für Fingernägel (2 Kurse) und Zehennägel (3 Kurse) | Wiederholung in Abständen von 21 Tagen | |
| Histoplasmose/Systemische Pilzinfektionen | 1 Monat bis 18 Jahre | 5 mg/kg (maximal 200 mg) ein- oder zweimal täglich | Wie verordnet; bei invasiver Erkrankung zweimal täglich |
| Prophylaxe bei Neutropenie | 1 Monat bis 18 Jahre | 5 mg/kg (max. 200 mg) täglich, erhöht auf zweimal täglich, wenn die Itraconazol-Plasmakonzentrationen niedrig sind | Wie vorgeschrieben |
| Prophylaxe bei hämatologischer Malignität | 1 Monat bis 18 Jahre | 2.5 mg/kg zweimal täglich | Beginn vor Transplantation oder Chemotherapie |
| Intravenöse Dosen bei systemischen Infektionen | 1 Monat bis 18 Jahre | 2.5 mg/kg (max. 200 mg) alle 12 Stunden in den ersten beiden Tagen, danach einmal täglich für maximal 12 Tage | Wie verordnet |
In Deutschland sollte der Patient oder eine helfende Person sofort den Notruf 112 wählen, um bei einem medizinischen Notfall, einschließlich einer Überdosierung, medizinische Hilfe zu erhalten.
Nebenwirkungen

In Deutschland gehören zu den häufigsten Nebenwirkungen von Itraconazol Magen-Darm-Störungen wie Übelkeit, Durchfall und Magenschmerzen. Einige Patienten berichten auch über Kopfschmerzen oder Schwindelgefühl während der Behandlung. Zu den seltenen, aber schwerwiegenden Nebenwirkungen gehören Leberfunktionsstörungen, die sich durch Gelbsucht oder dunklen Urin bemerkbar machen, und Hautreaktionen wie Hautausschläge. Insgesamt sind diese Nebenwirkungen in der Regel gering und verschwinden, wenn die Behandlung abgesetzt oder angepasst wird.
Zu den häufigsten unerwünschten Wirkungen im Zusammenhang mit Itraconazol gehören Dyspepsie, Bauchschmerzen, Übelkeit, Erbrechen, Verstopfung, Durchfall, Kopfschmerzen und Schwindelgefühl. Andere sind allergische Reaktionen wie Juckreiz, Hautausschlag, Urtikaria und Angioödem. Vereinzelte Fälle des Stevens-Johnson-Syndroms wurden mit Itraconazol in Verbindung gebracht. Bei einigen Patienten ist ein Anstieg der Leberenzymwerte aufgetreten, und es wurden Fälle von Hepatitis und cholestatischer Gelbsucht beobachtet, insbesondere bei Patienten, die länger als einen Monat behandelt wurden.
In seltenen Fällen ist es zu Leberversagen und Tod gekommen. Selten wurde über Herzversagen und Lungenödeme berichtet, und schwerwiegende kardiovaskuläre Ereignisse, einschließlich Herzrhythmusstörungen und plötzlicher Tod, wurden bei Patienten, die Itraconazol erhielten, auf Wechselwirkungen mit anderen Arzneimitteln zurückgeführt (siehe unten “Wechselwirkungen”). Alopezie, Ödeme und Hypokaliämie sind auch bei längerer Anwendung aufgetreten.
Bei einigen wenigen Patienten wurde über Menstruationsstörungen und periphere Neuropathie berichtet.
Häufigkeit von unerwünschten Wirkungen
Itraconazol in einer Dosierung von 50 bis 400 mg täglich über einen Zeitraum von durchschnittlich 5 Monaten wurde von 189 Patienten mit systemischen Pilzinfektionen gut vertragen. Von 86 Patienten mit Grunderkrankungen, darunter 49 mit AIDS, 16 mit Diabetes und 23 mit bösartigen Erkrankungen, traten bei 19 Patienten Übelkeit und Erbrechen, bei 16 eine Hypertriglyceridämie, bei 11 eine Hypokaliämie und bei 13 erhöhte Leberenzymwerte auf. Die Rolle von Itraconazol bei der Hypertriglyceridämie konnte nicht bewertet werden, da nicht alle Proben im nüchternen Zustand entnommen wurden und Hypertriglyceridämie eine Komplikation der HIV-Infektion ist.
Gynäkomastie trat bei 2 Patienten auf, von denen einer auch Spironolacton einnahm.
Hautausschlag trat bei 4 Patienten auf. Von 49 Patienten, die Itraconazol 100 bis 400 mg täglich über einen Zeitraum von bis zu 39 Monaten einnahmen, traten bei 23 keine unerwünschten Wirkungen auf, während bei 6 Patienten Übelkeit und Erbrechen, bei 5 Patienten Ödeme und bei 2 Patienten Bluthochdruck auftraten. 3 der Patienten, die Ödeme entwickelten und 1 Patient, der Bluthochdruck bekam, waren Diabetiker. Drei Patienten brachen die Behandlung mit Itraconazol ab, 1 aufgrund von Erbrechen, 1 wegen Leukopenie und 1 wegen eines nephrotischen Syndroms. Bei dem Patienten mit dem nephrotischen Syndrom bestanden bereits Ödeme und Bluthochdruck. Das Syndrom verschwand, als Itraconazol abgesetzt wurde.
Kardiovaskulär
Kammerflimmern wurde auf eine Itraconazol-induzierte Hypokaliämie zurückgeführt.
Bei einer Frau, die wegen einer lokalisierten Lungeninfektion mit Aspergillus fumigatus mit Itraconazol 200 mg täglich behandelt wurde, entwickelte sich ein Pleura- und anschließend ein Perikarderguss. Nach mehr als 9 Wochen Behandlung entwickelte sie einen Perikarderguss, der eine Drainage erforderte. Itraconazol wurde abgesetzt. Sechs Wochen später und 2 Wochen nach Wiederaufnahme der Itraconazol-Behandlung entwickelte sie Anzeichen eines Lungenödems und einer Herzvergrößerung. Diese Anzeichen verschwanden rasch nach Absetzen von Itraconazol.
Studien an Hunden und gesunden menschlichen Probanden lassen vermuten, dass Itraconazol eine negative inotrope Wirkung hat; der Mechanismus ist unbekannt. Eine systematische Analyse von Daten aus dem Adverse Event Reporting System (AERS) der FDA ergab 58 Fälle, die auf eine Herzinsuffizienz bei Patienten, die Itraconazol einnahmen, schließen lassen. Eine gleichzeitige Suche ergab keine Fälle von Herzinsuffizienz bei Patienten, die Fluconazol und Ketoconazol einnahmen, so dass die Möglichkeit eines Klasseneffekts ausgeschlossen werden kann. Infolgedessen wurde die Kennzeichnung von Itraconazol überarbeitet. Itraconazol ist nun für die Behandlung von Onychomykose bei Patienten mit Anzeichen einer Herzmuskelschwäche kontraindiziert.
Bei systemischen Pilzinfektionen sollten die Risiken und der Nutzen von Itraconazol neu bewertet werden, wenn Anzeichen oder Symptome einer Herzinsuffizienz auftreten.
Nervensystem
In einigen Berichten wurde über Kopfschmerzen aufgrund von Itraconazol berichtet. Schwindel ist eine seltene Beschwerde, ebenso wie Stimmungsschwankungen.
Psychologisch, psychiatrisch
Über visuelle Halluzinationen mit Verwirrung wurde bei einer 75-jährigen Frau berichtet, die bei drei verschiedenen Gelegenheiten auftraten, jedes Mal etwa 2 Stunden nach einer 200 mg-Dosis Itraconazol. Ihre Symptome klangen spontan innerhalb von 8 Stunden ab.
Elektrolytgleichgewicht
Eine Hypokaliämie, die entweder isoliert oder in Verbindung mit Bluthochdruck auftritt, wurde regelmäßig bei einem kleinen Teil der Patienten beobachtet. Ein ausgeprägtes Knöchelödem mit Gewichtszunahme wurde bei einem Patienten beobachtet, der Itraconazol 400 mg/Tag einnahm, wofür es keine andere Erklärung als die Einnahme des Arzneimittels gab; nach Absetzen des Itraconazols verschwanden die Symptome. Hypokaliämie und Ödeme wurden auch bei einer Reihe von Patienten beobachtet, die eine hochdosierte Therapie (600 mg/Tag) einnahmen, verbunden mit leicht erniedrigten Aldosteronkonzentrationen.
Gastrointestinaler Bereich
Dyspepsie, Pyrosis, Übelkeit, Erbrechen, leichtes epigastrisches Unbehagen und Durchfall können bei Patienten auftreten, die Itraconazol einnehmen. Diese gastrointestinalen Beschwerden sind im Allgemeinen leicht, scheinen aber die häufigsten unerwünschten Wirkungen während der Behandlung zu sein. Die Gesamthäufigkeit der unerwünschten Wirkungen betrug 3-5 % bei Patienten, die wegen einer oberflächlichen Mykose behandelt wurden, und 8 % bei 99 Patienten, die wegen einer tiefen Mykose behandelt wurden. In einer multizentrischen Studie wurde eine Inzidenz von eher 15 % angegeben.
Bei 50 Frauen mit akuter vaginaler Candidose wurden bei 17 (35 %) unerwünschte Wirkungen gemeldet, bei sieben Übelkeit, bei sechs Kopfschmerzen, bei drei Schwindel und bei drei Blähungen, während bei einer Frau die Aspartat-Transaminase-Aktivität erhöht war.
Von 1108 HIV-Patienten, die wegen einer Candidose der Schleimhäute behandelt wurden, berichteten 239 über gastrointestinale Symptome.
Pseudomembranöse Kolitis wurde im Zusammenhang mit der Einnahme von Itraconazol berichtet.
Bei einem 54-jährigen Mann traten 1 Monat nach einer 7-tägigen oralen Itraconazol-Behandlung (200 mg/Tag) erneut Bauchschmerzen und nicht-blutige Diarrhöe auf. Er nahm stabil chronisch Sertralin, Valproinsäure und Perphenazin ein und hatte seit 6 Monaten keine antimikrobiellen Medikamente mehr eingenommen. Eine flexible Sigmoidoskopie nach dem klinischen Verlauf zeigte Pseudomembranen, und die anschließende Untersuchung schloss andere Ursachen für die Diarrhöe aus. Obwohl die Clostridium-difficile-Kultur und der Toxintest schließlich negativ ausfielen, was möglicherweise auf eine verzögerte Stuhlprobenentnahme zurückzuführen war, sprach der Patient auf eine 10-tägige Behandlung mit antianerobischen Medikamenten an und wurde mit vollständig behobenen Symptomen entlassen.
Die Autoren vermuteten, dass Itraconazol die ansässige Pilzflora des Dickdarms gestört hatte.
Leber
In den meisten klinischen Berichten gab es einige Fälle erhöhter Leberenzymaktivitäten; die Veränderungen waren vorübergehend oder verschwanden nach Absetzen von Itraconazol. Schwerwiegendere Hepatotoxizität wurde nicht berichtet.
Über eine fokale noduläre Hyperplasie der Leber wurde bei einer 38-jährigen Frau berichtet, die Itraconazol 200 mg/Tag 4 Monate lang gegen eine Pilzinfektion der Fingernägel eingenommen hatte. In dem Jahr, in dem sich die fokale noduläre Hyperplasie entwickelte, hatte sie keine anderen Arzneimittel eingenommen.
Von drei Patienten, zwei Frauen im Alter von 62 und 57 Jahren und einem Mann im Alter von 75 Jahren, die 5-6 Wochen nach Beginn der Itraconazol-Einnahme eine symptomatische Leberschädigung entwickelten, wiesen zwei das biochemische Muster einer cholestatischen Leberschädigung auf.
Alle von der Janssen Research Foundation geförderten klinischen Itraconazol-Studien zur Behandlung von Onychomykose, bei denen eine Bewertung der Laborsicherheit vorgenommen wurde, wurden analysiert. Bei den Leberfunktionstests (Alanin-Transaminase, Aspartat-Transaminase, alkalische Phosphatase und Gesamtbilirubin) gab es keine signifikanten Unterschiede in der Anzahl der Code-4-Anomalien (Ausgangswert liegt im Referenzbereich und mindestens zwei Werte oder der letzte Test im Beobachtungszeitraum überschreiten das Doppelte der oberen Grenze des Referenzbereichs). Die Inzidenz aller Code-4-Anomalien lag unter 2 %. Die Itraconazol-Impulstherapie bei Onychomykose scheint sicher zu sein, insbesondere unter dem Gesichtspunkt einer möglichen Leberschädigung. In der Packungsbeilage von Itraconazol werden Leberfunktionstests bei Patienten empfohlen, die Itraconazol über einen Monat lang kontinuierlich erhalten. Für das Pulsregime ist eine solche Überwachung nicht erforderlich, es sei denn, der Patient hat eine zugrunde liegende Lebererkrankung in der Vorgeschichte, die Leberfunktionstests sind zu Beginn der Behandlung abnormal oder es treten zu irgendeinem Zeitpunkt Anzeichen oder Symptome auf, die auf eine Leberfunktionsstörung hindeuten.

Haut
Patienten, die Itraconazol einnehmen, haben über verschiedene Arten von Hautausschlag, einschließlich akneiformen Ausschlags, berichtet. In einem Fall traten blutige Bullae auf.
Ein 29-jähriger Mann entwickelte einen infiltrativen makulopapulösen Ausschlag nach einwöchiger Behandlung mit Itraconazol 100 mg täglich gegen Tinea corporis. Itraconazol wurde abgesetzt, und die Läsionen verschwanden innerhalb von 7 Tagen. Kratztests, Patch-Tests, Scratch-Patch-Tests und arzneimittelinduzierte Lymphozyten-Stimulationstests für Itraconazol waren negativ; eine erneute Behandlung mit systemischem Itraconazol löste jedoch einen makulopapulösen Ausschlag im Gesicht, an den Händen und auf der Fußrückseite aus. Leere Itraconazol-Kapseln hatten keine kutanen Wirkungen, was auf eine allergische Reaktion auf einen Metaboliten der Verbindung schließen lässt.
Photosensibilität wurde Itraconazol (200 mg pro Tag für 5 Tage) zugeschrieben, mit einer reduzierten minimalen Erythemdosis sowohl für UVB (0,12 J/cm) als auch für UVA (20,1 J/cm), einem negativen Photopatch-Test und einem positiven Phototest. Die Autoren vermuteten einen photoallergischen Mechanismus, da die frühere Exposition mit Itraconazol unauffällig war. Es wurden jedoch keine Einzelheiten über die Sonnenexposition während der ersten Exposition und die Intensität der Sonnenexposition während des oralen Photo-Challenge-Verfahrens angegeben. Der Hautausschlag sprach auf orale Steroide an, was eher typisch für photoallergische als für phototoxische Reaktionen ist.
Das Risiko schwerwiegender Hauterkrankungen wurde bei 61 858 Anwendern oraler Antimykotika im Alter von 20 bis 79 Jahren geschätzt, die in der britischen General Practice Research Database identifiziert wurden. Sie hatten mindestens eine Verschreibung für orales Fluconazol, Griseofulvin, Itraconazol, Ketoconazol oder Terbinafin erhalten. Die Hintergrundrate schwerwiegender kutaner Nebenwirkungen (entsprechend der Nichtverwendung oraler Antimykotika) betrug 3,9 pro 10 000 Personenjahre (95% CI = 2,9). Die Inzidenzraten für die aktuelle Anwendung lagen bei 15 pro 10 000 Personenjahre (1 für Itraconazol, 11,1 (3 für Terbinafin, 10 (1 für Fluconazol und 4,6 (0 für Griseofulvin. Die mit der Einnahme oraler Antimykotika verbundenen Hauterkrankungen waren in dieser Studie alle leicht.
Sexuelle Funktion
Es gibt widersprüchliche Berichte über die Auswirkungen von Itraconazol auf Sexualsteroide. Die Konzentrationen von Testosteron, Kortikosteron und Progesteron blieben bei Ratten und sechs Hunden, bei denen mögliche endokrine Wirkungen untersucht wurden, unverändert. Andererseits führte die zweiwöchige Verabreichung von Itraconazol an sieben männliche Probanden nicht zu nachweisbaren Veränderungen der Plasmakonzentrationen von Testosteron oder Cortisol. Zwei Wochen nach Beginn einer hochdosierten Itraconazol-Therapie (600 mg/Tag) zeigte einer von acht Patienten mit schwerer Mykose eine leicht verminderte Cortisol-Antwort auf ACTH-Stimulation.
Es wurde über erektile Impotenz bei normalen Steroidkonzentrationen sowie über eine Verringerung der Libido berichtet.
Immunologische
Itraconazol 200 mg pro Tag über 2 Wochen verursachte bei einer 53-jährigen Frau mit Morbus Menière eine serumkrankheitsähnliche Reaktion.
Die meisten der gemeldeten unerwünschten Wirkungen von Itraconazol sind vorübergehend. Gastrointestinale Reaktionen, leichte Dyspepsie, Pyrosis, Übelkeit, Erbrechen, Durchfall und epigastrische Schmerzen sind keine Seltenheit. In vielen der veröffentlichten Berichte werden Erhöhungen der Serum-Leberenzymaktivitäten und Hypertriglyceridämie erwähnt, und es wurde über symptomatische Lebertoxizität berichtet. Itraconazol induziert keine arzneimittelmetabolisierenden Enzyme und ist ein schwächerer Inhibitor mikrosomaler Enzyme als Ketoconazol. Bei Ratten, denen Dosen von bis zu 160 mg/kg verabreicht wurden, kam es zu keiner Induktion oder Hemmung des Metabolismus von Xenobiotika.
Es wurde häufig über Hypokaliämie berichtet, ohne dass der Mechanismus erklärt wurde. Höhere Dosen (400 oder sogar 600 mg/Tag) führen zu einer erhöhten Inzidenz von unerwünschten Wirkungen; unter anderem wurden bei diesen Dosierungen eine schwere Hypokaliämie, eine reversible Nebenniereninsuffizienz und (in einem veröffentlichten Fall) Herzrhythmusstörungen dokumentiert, letztere im Zusammenhang mit einer Wechselwirkung mit Terfenadin. Es wurde über Hautausschläge und Juckreiz berichtet. Tumorauslösende Wirkungen sind nicht beschrieben worden.
Die häufigsten unerwünschten Wirkungen bei Patienten, die Itraconazol-Kapseln über einen längeren Zeitraum einnahmen, waren Übelkeit und Erbrechen (unter 10 %), Hypertriglyceridämie (9 %), Hypokaliämie (6 %), erhöhte Transaminasen (5 %), Hautausschläge und/oder Juckreiz (2 %), Kopfschmerzen oder Schwindel (unter 2 %) und Fußödeme (1 %).
In einer Studie, bei der die UK General Practice Research Database zur Ermittlung der Häufigkeit seltener, schwerwiegender arzneimittelinduzierter unerwünschter Wirkungen auf Leber, Nieren, Haut oder Blut herangezogen wurde, die innerhalb von 45 Tagen nach Beendigung einer Verschreibung oder Wiederauffüllung eines Rezepts bei 54 803 Anwendern von Fluconazol oder Itraconazol auftraten, wies ein Patient während der Einnahme von Itraconazol einen abnormen Leberfunktionstest auf, bei dem eine arzneimittelinduzierte Ätiologie nicht ausgeschlossen werden konnte, was einer Häufigkeit von 3,2 pro 100 000 Verordnungen entspricht (95% CI für schwerwiegende unerwünschte Leberwirkungen). Somit hat Itraconazol in der Regel keine schwerwiegenden unerwünschten Wirkungen auf Leber, Nieren, Haut oder Blut.
Weitere Informationen zu diesem Medikament finden Sie beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM).
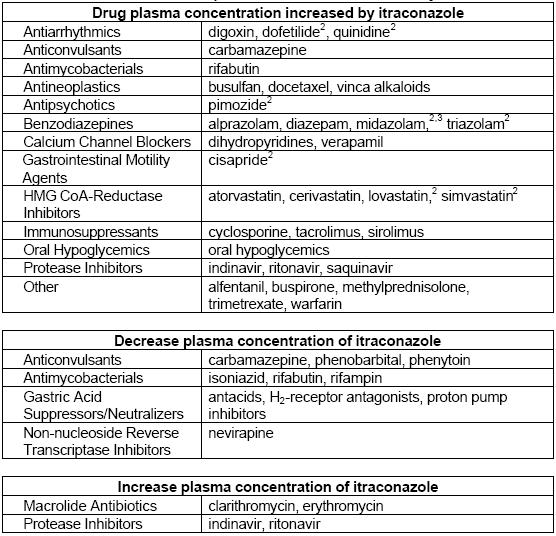
Wechselwirkungen
| Kategorie | Arzneimittel | Wechselwirkung mit Itraconazol | Wirkungen |
|---|---|---|---|
| Statine | Atorvastatin | Erhöhte Serumkonzentrationen aufgrund von CYP3A4-Hemmung. | AUC um 150% erhöht, Cmax um 38% erhöht, Halbwertszeit um 30% verlängert. |
| Cerivastatin | Mäßiger Anstieg der Serumkonzentrationen; der sekundäre CYP2C8-Stoffwechselweg wird durch Itraconazol nicht beeinträchtigt. | Geringe Anstiege der AUC, Cmax und Halbwertszeit (bis zu 51%, 25% bzw. 23%). | |
| Fluvastatin | Keine signifikante Wirkung auf Cmax oder AUC; leichte Verlängerung der Halbwertszeit. | Minimale Wechselwirkung; gilt als sicher mit Itraconazol. | |
| Lovastatin | Erhöhte die Plasmakonzentrationen selbst bei niedrigen Itraconazol-Dosen stark. | Cmax um das ~15-fache erhöht, Gesamt-AUC um das >15-fache erhöht; Vorsicht geboten. | |
| Pravastatin | Leichter Anstieg der AUC und Cmax; Änderungen statistisch nicht signifikant. | Die Halbwertszeit bleibt unverändert; minimale Wechselwirkung beobachtet. | |
| Simvastatin | Deutlich erhöhte systemische Exposition bei Kombination mit Itraconazol. | Cmax und AUC um mindestens das 10-fache erhöht; in einigen Fällen wurde ein erhebliches Risiko für Rhabdomyolyse festgestellt. | |
| Glucocorticoide | Budesonid | Erhöhte metabolische Clearance-Hemmung, die bei einigen Patienten zu Nebennierenversagen führt. | AUC um das 4,2-fache erhöht, Halbwertszeit von 1,6 auf 6,2 Stunden verlängert; signifikante Cortisol-Suppression beobachtet. |
| Dexamethason | Deutlich erhöhte systemische Exposition und Wirkungen aufgrund einer reduzierten Clearance durch Itraconazol. | Die AUC stieg fast um das Vierfache, die Halbwertszeit verlängerte sich um mehr als das Dreifache; niedrigere Cortisolspiegel wurden beobachtet. | |
| Methylprednisolon | Signifikanter Anstieg der Exposition aufgrund der CYP3A4-Hemmung durch Itraconazol. | AUC um das 3,9-fache erhöht, Halbwertszeit von 2,1 auf 4,8 Stunden verlängert; verstärkte Nebennierensuppression beobachtet. | |
| Prednisolon | Geringe Wechselwirkung mit begrenzter klinischer Bedeutung im Vergleich zu Methylprednisolon. | AUC um 24% erhöht, Halbwertszeit um 29% verlängert; im Allgemeinen sichere Anwendung mit Itraconazol. |
Andere Wechselwirkungen
Tacrolimus
Die Konzentrationen und die Toxizität von Tacrolimus werden durch Itraconazol beeinflusst.
- Bei einem 17-jährigen Mann mit zystischer Fibrose, der eine Leber-Lungen-Transplantation erhielt, kam es zu einer Wechselwirkung von Itraconazol 600 mg täglich mit Tacrolimus. Trotz der relativ niedrigen Dosierung (0,1-0,3 mg/kg/Tag) wurden hohe Trogkonzentrationen von Tacrolimus festgestellt.
- Bei einem anderen Patienten kam es zu einer Wechselwirkung zwischen Tacrolimus 0,085 mg/kg/Tag und Itraconazol 200-400 mg/Tag, die zu Ketoazidose, Neutropenie und Thrombozytopenie führte, so dass beide Arzneimittel abgesetzt werden mussten.
- Bei einem 30-jährigen nierentransplantierten Mann kam es nach Beginn der Einnahme von Itraconazol 200 mg/Tag zu einem mehr als zweifachen Anstieg der Tacrolimuskonzentration im Blut, begleitet von einer verringerten glomerulären Filtrationsrate und einer durch Biopsie nachgewiesenen Tacrolimus-assoziierten Tubulopathie.
Da Tacrolimus einen engen therapeutischen Index hat, sollten die Blutkonzentrationen bei gleichzeitiger Verabreichung von Itraconazol besonders sorgfältig überwacht werden, und die Dosierung von Tacrolimus muss möglicherweise geändert werden.
Die Wechselwirkung von Itraconazol (100 mg pro Tag) mit Tacrolimus wurde bei 28 Herz- oder Lungentransplantatempfängern untersucht. Die Tacrolimus-Blutkonzentrationen wurden an abwechselnden Tagen bis zu 21 Tage nach Beginn oder Absetzen der Itraconazol-Therapie überwacht. Die Tacrolimus-Dosis wurde so angepasst, dass die 12-Stunden-Trog-Blutkonzentration bei 7-12 Mikrogramm/ml lag.
Die mittlere Tacrolimus-Dosis sank während der Itraconazol-Therapie signifikant von 8,4 auf 2,9 mg/Tag. Es gab keine signifikante Veränderung des Serumkreatinins oder der Leberfunktionstests. Bei Patienten, bei denen Itraconazol abgesetzt wurde, stieg die mittlere erforderliche Tacrolimus-Dosis signifikant von 4,7 auf 8,8 mg/Tag. Somit waren sowohl bei Beginn als auch bei Absetzen von Itraconazol erhebliche Änderungen der Tacrolimus-Dosis erforderlich, und es war schwierig, die Tacrolimus-Blutkonzentrationen in den ersten zwei Wochen im Zielbereich zu halten. Größere Toxizitäten oder Abstoßungsreaktionen traten jedoch nicht auf.
Die gleichzeitige Verabreichung von Itraconazol kann die Kosten der Immunsuppression nach der Transplantation senken. Diese Wechselwirkung ist wahrscheinlich auf die Hemmung von CYP3A4 durch Itraconazol zurückzuführen.
Vinca-Alkaloide
Über die verstärkte und potenziell lebensbedrohliche Neurotoxizität von Vinca-Alkaloiden durch die gleichzeitige Therapie mit Itraconazol gibt es mehrere überzeugende Berichte. Die Verstärkung der Neurotoxizität von Vincristin führt zu Polyneuropathie und paralytischem Ileus. Die Wechselwirkung ist reversibel, und die Einnahme von Vinca-Alkaloiden kann nach längerem Absetzen sicher sein. Der Mechanismus ist noch nicht formell geklärt, könnte aber entweder in einem Wettbewerb um den oxidativen Stoffwechsel bestehen, was zu einer erhöhten systemischen Exposition führt, oder in einer Hemmung der transmembranen P-Glykoprotein-Effluxpumpe, was zu erhöhten intrazellulären Konzentrationen von Vinca-Alkaloiden führt. Die gleichzeitige Anwendung von Itraconazol und Vinca-Alkaloiden ist daher kontraindiziert.
Zwei Erwachsene mit akuter lymphatischer Leukämie entwickelten eine ungewöhnlich schwere Neurotoxizität durch Vincristin, die wahrscheinlich auf eine Wechselwirkung mit Itraconazol-Suspension zurückzuführen ist.
Warfarin
Itraconazol kann die Warfarinkonzentrationen verändern.
Nach der Zugabe von Itraconazol zu einem Behandlungsschema aus Warfarin, Ranitidin und Terfenadin entwickelten sich bei einem 62-jährigen Mann Herzrhythmusstörungen. Zu den Anzeichen und Symptomen gehörten eine Verlängerung des QT-Intervalls und Herzkammerflimmern.
Bei diesem speziellen Regime kam es offenbar zu einer zweiten Wechselwirkung, da unerwartet hohe Konzentrationen von Terfenadin festgestellt wurden. Andere haben dieses Phänomen beschrieben, das einen deutlichen Anstieg der Terfenadin-Serumkonzentrationen und eine erhöhte Arzneimitteltoxizität bei gleichzeitiger Einnahme von Itraconazol beinhaltet. Der Mechanismus ist nicht bekannt, hängt aber wahrscheinlich mit der Hemmung von CYP3A4 zusammen.
Zolpidem
Zolpidem wird hauptsächlich durch CYP3A4 umgewandelt. Itraconazol 200 mg veränderte jedoch die Pharmakokinetik und Pharmakodynamik von Zolpidem 10 mg bei 10 gesunden Freiwilligen nicht. Daher kann Zolpidem in normalen oder nahezu normalen Dosen zusammen mit Itraconazol angewendet werden.
Amphotericin
Sechs Stämme von A. fumigates wurden verwendet, um die In-vitro-Wirkungen der Kombination von Amphotericin mit Itraconazol zu testen. Nach Vorbehandlung wurde für alle Stämme in vitro und für einen Stamm in einem Mausmodell der Aspergillose eine antagonistische Wirkung festgestellt.
Die Wirkung der Kombination von Itraconazol mit Amphotericin auf die Leberenzymaktivitäten wurde retrospektiv bei 20 Patienten mit hämatologischen Malignomen oder chronischen Lungenerkrankungen, die durch eine Pilzinfektion oder -kolonisation kompliziert waren, untersucht. Sie nahmen Itraconazol 200-600 mg/Tag für einen Median von 143 (Bereich 44 Tage) ein. Neun von ihnen wiesen keine abnormalen Leberfunktionstests auf, einschließlich Perioden mit hohen Konzentrationen von Itraconazol (über 5000 µg/ml) und seinem aktiven hydroxylierten Metaboliten; nur einer hatte gleichzeitig Amphotericin erhalten. Alle 11 Patienten mit Leberfunktionsanomalien hatten gleichzeitig Amphotericin erhalten.
Bei allen Patienten waren die Leberfunktionsstörungen während der gleichzeitigen Behandlung mit beiden Antimykotika am größten. Obwohl Leberenzymanomalien bei Amphotericin selten sind und diese retrospektive Analyse mit mehreren Mängeln und potenziellen Verzerrungen behaftet war, legt sie dennoch nahe, dass die Hepatotoxizität bei gleichzeitiger Verabreichung von Itraconazol und Amphotericin sorgfältig überwacht werden sollte.
Antihistaminika
Es scheint wahrscheinlich, dass die Kombination von Itraconazol mit Astemizol und Terfenadin zu einer verstärkten Wirkung dieser Antihistaminika führt.
Barbiturate
Barbiturate senken die Itraconazol-Konzentration.
Benzodiazepine
Die Wirkung von Itraconazol auf die Pharmakokinetik und Pharmakodynamik von Estazolam bei oraler Einzeldosis wurde in einer doppelblinden, randomisierten Crossover-Studie an 10 gesunden männlichen Freiwilligen untersucht, die 7 Tage lang oral 100 mg Itraconazol/Tag oder Placebo und am 4. Bis zu 72 Stunden nach der Verabreichung von Estazolam wurden Blutproben entnommen und die psychomotorischen Funktionen mit dem Digit Symbol Substitution Test, der visuellen Analogskala und der Stanford Sleepiness Scale bewertet. Es gab keinen signifikanten Unterschied zwischen der Placebo- und der Itraconazol-Phase hinsichtlich der Spitzenplasmakonzentration, der Clearance und der Halbwertszeit. Auch die psychomotorische Funktion war nicht beeinträchtigt. Diese Ergebnisse deuten darauf hin, dass CYP3A4 nicht in erheblichem Maße am Metabolismus von Estazolam beteiligt ist.
In einer Studie über die Auswirkungen von Itraconazol 200 mg/Tag und Rifampicin 600 mg/Tag auf die Pharmakokinetik und Pharmakodynamik von oralem Midazolam 7,5-15 mg während und 4 Tage nach Beendigung der Behandlung führte der Wechsel von der Hemmung zur Induktion des Metabolismus zu einer bis zu 400-fachen Veränderung der AUC von oralem Midazolam.
Bupivacain
Die Wechselwirkung von Itraconazol 200 mg oral über 4 Tage mit einer einzigen intravenösen Dosis von racemischem Bupivacain (0,3 mg/kg über 60 Minuten verabreicht) wurde in einer placebokontrollierten Crossover-Studie an 10 gesunden Freiwilligen untersucht. Itraconazol verringerte die Clearance von R-Bupivacain um 21 % und die von 5-Bupivacain um 25 %, hatte aber keine anderen signifikanten Auswirkungen auf die Pharmakokinetik der Enantiomere. Die Verringerung der Bupivacain-Clearance durch Itraconazol erhöht wahrscheinlich die Steady-State-Konzentrationen der Bupivacain-Enantiomere um 20-25 %, was bei der gleichzeitigen Anwendung von Itraconazol und Bupivacain berücksichtigt werden sollte.
Buspiron
Die Wechselwirkung von Itraconazol mit dem aktiven l-(2-Pyrimidinyl)-piperazin-Metaboliten von Buspiron wurde nach einer oralen Einzeldosis von 10 mg Buspiron untersucht. Itraconazol verringerte die mittlere AUC des Metaboliten um 50 % und die Cmax um 57 %, während die mittlere AUC und Cmax des Ausgangsstoffes um das 14,5-fache bzw. 10,5-fache erhöht wurden. Somit verursachte Itraconazol relativ geringe Veränderungen der Plasmakonzentrationen des aktiven Piperazin-Metaboliten von Buspiron, obwohl es erhebliche Auswirkungen auf die Konzentrationen von Buspiron nach einer einzigen oralen Dosis hatte.
Busulfan
Es wurde über eine verringerte Ausscheidung und erhöhte Toxizität von Busulfan bei gleichzeitiger Verabreichung mit Itraconazol berichtet.
Carbamazepin
Bei gleichzeitiger Verabreichung von Itraconazol mit Carbamazepin wurden niedrige und manchmal sehr niedrige Serumkonzentrationen von Itraconazol beobachtet.
Ciclosporin
Die Kombination von Itraconazol mit Ciclosporin führt zu einem deutlichen Anstieg der Ciclosporin-Konzentrationen im Blut, was zu einem Anstieg des Serumkreatinins führen kann. Dies deutet eindeutig auf eine Nierenschädigung durch die hohen Ciclosporin-Konzentrationen hin. Eine Wechselwirkung ist jedoch nicht in allen Fällen nachgewiesen worden.
Es wurde über zwei Fälle von Rhabdomyolyse berichtet, die durch Itraconazol bei Empfängern von Herztransplantaten verursacht wurde, die langfristig Ciclosporin und Simvastatin einnahmen. Um eine schwere Myopathie zu vermeiden, sollten die Ciclosporin-Konzentrationen häufig überwacht werden, und Statine sollten abgesetzt oder die Dosierung reduziert werden, solange Azole bei Transplantatempfängern verschrieben werden müssen. Die Patienten müssen über Anzeichen und Symptome aufgeklärt werden, die ein sofortiges Eingreifen des Arztes erfordern.
Zitrat-Phosphat-Puffer
Der Citrat-Phosphat-Puffer, der verwendet wird, um die Absorption von Dideoxyinosin (Didanosin) zu erleichtern, das zur Behandlung von AIDS verschrieben wird, kann die Absorption von Itraconazol beeinträchtigen.
Clarithromycin
Ein Bericht über drei HIV-negative Patienten deutet darauf hin, dass die gleichzeitige Therapie mit Itraconazol und Clarithromycin zu einer erhöhten Clarithromycin-Exposition führen kann, mit einem erhöhten metabolischen Verhältnis, das möglicherweise mit der Wirkung von Itraconazol auf CYP3A4 zusammenhängt. Dennoch traten bei keiner der drei berichteten Personen unerwünschte Wirkungen aufgrund dieser vermuteten Wechselwirkung auf.
Clozapin
Itraconazol 200 mg hatte keinen signifikanten Einfluss auf die Serumkonzentrationen von Clozapin 200-550 mg/Tag oder Desmethylclozapin bei 7 schizophrenen Patienten.
Digoxin
Itraconazol hemmt die Ausscheidung von Digoxin, was möglicherweise zu Toxizität führt.
Itraconazol erhöht die AUC0_72 von Digoxin um etwa 50 % und verringert seine renale Clearance um etwa 20 %. Abgesehen von der Hemmung der renalen Sekretion von Digoxin, die wahrscheinlich durch eine Hemmung des P-Glykoproteins vermittelt wird, zeigte eine Studie an Meerschweinchen auch eine signifikant verringerte biliäre Ausscheidung von Digoxin durch Itraconazol, was darauf hindeutet, dass die Wechselwirkung zwischen Itraconazol und Digoxin möglicherweise nicht nur auf eine Verringerung der renalen Clearance, sondern auch auf eine Verringerung der metabolischen Clearance von Digoxin durch Itraconazol zurückzuführen ist.
Die Bedeutung dieser Wechselwirkung wurde durch einen Bericht über zwei nierentransplantierte Patienten unterstrichen, die bei gleichzeitiger Einnahme von Itraconazol eine Digoxin-Toxizität aufwiesen.
Famotidin
Famotidin 40 mg/kg/Tag verringerte die Spitzen- und Trogkonzentrationen von Itraconazol 200 mg/kg/Tag bei 18 Patienten, die sich einer Chemotherapie für hämatologische Malignome unterzogen, um etwa 35 %.
Fentanyl
Fentanyl ist ein Substrat von CYP3A4, CYP2C9 und CYP2C19. In einer Studie waren jedoch die Pharmakokinetik und Pharmakodynamik von Fentanyl 3 Mikrogramm/kg nach Itraconazol 200 mg und Placebo bei 10 gesunden Freiwilligen ähnlich.
Über eine Wechselwirkung von Itraconazol mit Fentanyl wurde bei einem 67-jährigen krebskranken Mann berichtet, der eine stabile Dosis von transdermalem Fentanyl 50 Mikrogramm/Stunde erhielt. Er nahm 200 mg Itraconazol pro Tag zur Behandlung einer oropharyngealen Candidose ein und entwickelte 24 Stunden später Anzeichen einer Opioidtoxizität, die sich durch Absetzen von Fentanyl und Ersetzen durch kurz wirksame Opioide umkehren ließ.
Möglicherweise handelt es sich um eine Wechselwirkung, für die nur einige Personen empfänglich sind.
Flucytosin
Die Kombination von Itraconazol mit Flucytosin kann die Wirkung von Itraconazol gegen schwarze Pilze verstärken; diese Kombination hat die Entwicklung einer Flucytosin-Resistenz verhindert.
Wichtige Sicherheitsinformationen
Alter
Die Sicherheit, Verträglichkeit und Pharmakokinetik von Itraconazol und seinem aktiven Metaboliten Hydroxyitraconazol nach Verabreichung von Itraconazol-Lösung in Hydroxypropyl-P-Cyclodextrin wurden in einer multizentrischen Studie an 26 Säuglingen und Kindern im Alter von 6 Monaten bis 12 Jahren mit Schleimhautcandidiasis oder mit dem Risiko einer invasiven Pilzerkrankung untersucht. Es zeigte sich ein Trend zu niedrigeren minimalen Plasmakonzentrationen bei Kindern im Alter von 6 Monaten bis 2 Jahren. Die systemische Absorption des Lösungsvermittlers Hydroxypropyl-P-Cyclodextrin betrug weniger als 1 %. Bei einer Dosierung von 5 mg/kg/Tag lieferte diese Formulierung potenziell therapeutische Plasmakonzentrationen, die etwas niedriger waren als die bei Erwachsenen erreichten, und sie war gut verträglich und sicher.
Itraconazol 100 mg/Tag wurde bei 24 Kindern mit Trichophyton tonsurans tinea capitis untersucht. Itraconazol wurde gut vertragen, aber 15 Kinder mussten aufgrund einer anhaltenden Infektion erneut behandelt werden.
Die Sicherheit, Pharmakokinetik und Pharmakodynamik einer oralen Suspension von Cyclodextrin-Itraconazol (2,5 mg/kg od oder bd für 15 Tage) wurden in einer offenen, sequenziellen Dosis-Eskalationsstudie an 26 HIV-infizierten Kindern und Jugendlichen im Alter von 5-18 Jahren (mittlere CD4-Zahl 128 x 106/1) mit oropharyngealer Candidose untersucht. Abgesehen von leichten bis mäßigen gastrointestinalen Störungen bei drei Patienten wurde Cyclodextrin-Itraconazol gut vertragen.
Zwei Patienten brachen die Behandlung wegen unerwünschter Ereignisse vorzeitig ab. Der Score für die oropharyngeale Candidose sank signifikant von einem Mittelwert von 7,46 bei Studienbeginn auf 2,8 am Ende der Therapie, was die antimykotische Wirksamkeit in diesem Bereich belegt. Auf der Grundlage dieser Ergebnisse wurde für die Behandlung der oropharyngealen Candidose bei Kindern im Alter von 5 Jahren und darüber eine Dosierung von 2,5 mg/ kg pro Tag empfohlen.
Die Sicherheit und Wirksamkeit von oralem Cyclodextrin-Itraconazol (5 mg/kg/Tag) als antimykotische Prophylaxe wurde in einer offenen Studie an 103 neutropenischen Kindern (mittleres Alter 5 Jahre; Bereich 0-15 Jahre) untersucht. Die Prophylaxe wurde mindestens 7 Tage vor Beginn der Neutropenie begonnen und bis zur Erholung der Neutrophilen fortgesetzt. Von den 103 Patienten beendeten nur 47 die Prophylaxe; 27 schieden wegen mangelnder Compliance, 19 wegen unerwünschter Ereignisse und 10 aus anderen Gründen aus. Schwerwiegende unerwünschte Ereignisse (außer dem Tod) traten bei 21 Patienten auf, darunter Krämpfe, vermutete Arzneimittelwechselwirkungen, Bauchschmerzen und Verstopfung. Die häufigsten unerwünschten Ereignisse, die als definitiv oder möglicherweise mit Itraconazol in Zusammenhang stehend angesehen wurden, waren Erbrechen, abnorme Leberwerte und Unterleibsschmerzen.
Die Verträglichkeit des Studienmedikaments am Endpunkt wurde als gut (55 %), mäßig (11 %), schlecht (17 %) oder inakzeptabel (17 %) eingestuft. Es traten keine unerwarteten Probleme mit der Sicherheit oder Verträglichkeit auf.
Schwangerschaft, Fertilität und Laktation
Obwohl es bisher keine angemessenen und kontrollierten Studien am Menschen gibt, hat sich Itraconazol bei Tieren als teratogen und embryotoxisch erwiesen. Daher sollte Itraconazol während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen die möglichen Risiken für den Fötus rechtfertigt.
Für die Behandlung der Onychomykose ist die Anwendung von Itraconazol bei schwangeren Frauen kontraindiziert und auch bei Frauen, die eine Schwangerschaft in Erwägung ziehen, kontraindiziert.
Wenn eine Itraconazol-Therapie zur Behandlung von Onychomykose bei einer Frau im gebärfähigen Alter eingeleitet wird, sollte die erste Dosis des Arzneimittels am zweiten oder dritten Tag der nächsten normalen Menstruationsperiode verabreicht werden, und es sollten Maßnahmen ergriffen werden, um sicherzustellen, dass eine wirksame Empfängnisverhütung während der gesamten Itraconazol-Therapie und für zwei weitere Monate nach Absetzen des Arzneimittels fortgesetzt wird. In Reproduktionsstudien verursachte Itraconazol einen dosisabhängigen Anstieg der maternalen Toxizität, der Embryotoxizität und der Teratogenität bei Ratten in Dosierungen von etwa 40-160 mg/kg täglich (das 5-20fache der empfohlenen Höchstdosis für den Menschen) und bei Mäusen in Dosierungen von etwa 80 mg/kg täglich (das 10fache der empfohlenen Höchstdosis für den Menschen).
Die Teratogenität bestand in schweren Skelettdefekten bei Ratten und Enzephalozelen und/oder Makroglossie bei Mäusen.
Obwohl eine elterliche Toxizität beobachtet wurde, ergaben Reproduktionsstudien an männlichen und weiblichen Ratten, die orale Itraconazol-Dosierungen von bis zu 40 mg/kg täglich (das Fünffache der empfohlenen Höchstdosis für den Menschen) erhielten, keine Hinweise auf eine Beeinträchtigung der Fruchtbarkeit. Bei einer Dosierung von 160 mg/kg täglich (das 20-fache der empfohlenen Höchstdosis für den Menschen) trat eine schwerere parentale Toxizität, einschließlich Tod, auf.
Itraconazol geht in die Muttermilch über, und der erwartete Nutzen von Itraconazol für die stillende Frau sollte gegen das potenzielle Risiko für den Säugling durch die Exposition gegenüber dem Arzneimittel abgewogen werden. Wegen der möglichen Übertragung von HIV auf ein nicht infiziertes Kind empfehlen die US-amerikanischen Centers for Disease Control and Prevention (CDC) derzeit, dass HIV-infizierte Frauen ihre Säuglinge nicht stillen.
Vorsichtsmaßnahmen in Bezug auf kardiovaskuläre Wirkungen
Herzinsuffizienz, periphere Ödeme und Lungenödeme wurden bei immungeschwächten oder immunkompetenten Patienten, die Itraconazol intravenös oder oral zur Behandlung von systemischen Pilzinfektionen erhielten, sowie bei immunkompetenten Patienten, die Itraconazol-Kapseln zur Behandlung von Onychomykose einnahmen, berichtet. Itraconazol-Kapseln sollten nicht zur Behandlung von Onychomykose bei Patienten mit Anzeichen einer ventrikulären Dysfunktion, wie z. B. kongestiver Herzinsuffizienz, oder einer kongestiven Herzinsuffizienz in der Vorgeschichte angewendet werden.
Bei anderen Indikationen (z. B. Behandlung von systemischen Pilzinfektionen) sollte Itraconazol bei Patienten mit Anzeichen einer ventrikulären Dysfunktion nur dann intravenös oder oral verabreicht werden, wenn der Nutzen die Risiken eindeutig überwiegt.
Kliniker sollten die Risiken und den Nutzen einer Itraconazol-Therapie bei Patienten mit Risikofaktoren für eine kongestive Herzinsuffizienz sorgfältig abwägen (z. B. bei Patienten mit Herzerkrankungen wie ischämischen und Herzklappenerkrankungen, klinisch bedeutsamen Lungenerkrankungen wie chronisch obstruktiver Lungenerkrankung oder Nierenversagen und anderen ödematösen Erkrankungen), und Itraconazol intravenös oder als orale Lösung sollte bei diesen Patienten mit Vorsicht angewendet werden.
Wenn Itraconazol bei Patienten mit Risikofaktoren für eine kongestive Herzinsuffizienz als notwendig erachtet wird, sollten sie über die Anzeichen und Symptome einer kongestiven Herzinsuffizienz informiert und während der Therapie sorgfältig überwacht werden. Patienten, die während der Behandlung mit Itraconazol-Kapseln eine kongestive Herzinsuffizienz entwickeln, sollten das Arzneimittel absetzen. Tritt während der Therapie mit Itraconazol i.v. oder Itraconazol Lösung zum Einnehmen eine kongestive Herzinsuffizienz auf, sollte der Patient sorgfältig überwacht und die therapeutischen Möglichkeiten (einschließlich des möglichen Absetzens des Arzneimittels) geprüft werden.
Da Itraconazol und sein Hauptmetabolit, Hydroxyitraconazol, starke Inhibitoren des Cytochrom P-450 (CYP) 3A4 Isoenzymsystems sind, kann die gleichzeitige Anwendung des Antimykotikums mit Arzneimitteln, die durch diese Enzyme metabolisiert werden, die Plasmakonzentrationen dieser Arzneimittel erhöhen, was zu einer potenziellen Zunahme ihrer therapeutischen und unerwünschten Wirkungen führt. Schwerwiegende unerwünschte kardiovaskuläre Wirkungen (QT-Verlängerung, Torsades de pointes, ventrikuläre Tachykardie, Herzstillstand und/oder plötzlicher Tod) wurden bei Patienten berichtet, die Itraconazol gleichzeitig mit bestimmten Arzneimitteln erhielten, die durch CYP3A4-Enzyme metabolisiert werden (z. B. Cisaprid, Dofetilid, Pimozid, Chinidin), und die gleichzeitige Anwendung mit diesen Arzneimitteln ist kontraindiziert.
Vorsichtsmaßnahmen in Bezug auf hepatische Wirkungen
Da seltene Fälle von schwerwiegender Hepatotoxizität mit Itraconazol berichtet wurden, einschließlich einiger Fälle innerhalb der ersten Woche der Therapie, sollte Itraconazol nicht bei Patienten mit erhöhten Serum-Leberenzymen, aktiver Lebererkrankung oder einer Vorgeschichte von Lebertoxizität mit anderen Medikamenten angewendet werden, es sei denn, der potenzielle Nutzen übersteigt die Risiken. Die Konzentrationen der Leberenzyme im Serum sollten bei allen Patienten mit vorbestehenden Leberfunktionsstörungen und bei Patienten, die eine Lebertoxizität mit anderen Arzneimitteln erfahren haben, überwacht werden.
Darüber hinaus sollte bei allen Patienten, die Itraconazol erhalten, eine Überwachung der Leberenzymkonzentration in Erwägung gezogen werden, insbesondere bei Patienten, die länger als 1 Monat kontinuierlich mit Itraconazol behandelt werden. Itraconazol sollte sofort abgesetzt werden, und es sollten Leberfunktionstests durchgeführt werden, wenn während der Therapie Anzeichen und Symptome auftreten, die auf eine Lebererkrankung hindeuten. Die Risiken und der Nutzen von Itraconazol sollten bei diesen Patienten neu abgewogen werden. Die Patienten sollten angewiesen werden, Itraconazol sofort abzusetzen und ihren Arzt zu kontaktieren, wenn Anzeichen oder Symptome einer Leberfunktionsstörung auftreten, einschließlich ungewöhnlicher Müdigkeit, dunklem Urin, blassem Stuhl, Anorexie, Übelkeit, Erbrechen oder Gelbsucht, damit entsprechende Labortests durchgeführt werden können.
Andere Vorsichtsmaßnahmen und Kontraindikationen
Wenn Neuropathie auftritt, die auf Itraconazol zurückzuführen sein könnte, sollte das Medikament abgesetzt werden. Da Itraconazol eine Hypokaliämie verursachen kann, empfehlen einige Kliniker die Überwachung der Serumkaliumkonzentration bei Patienten, die relativ hohe Dosen und/oder eine längere Therapie mit dem Arzneimittel erhalten. Itraconazol ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen das Arzneimittel oder einen Bestandteil der Formulierung.
Obwohl keine Informationen über Kreuzempfindlichkeiten zwischen Itraconazol und anderen Triazol- oder Imidazol-Antimykotika vorliegen, weist der Hersteller darauf hin, dass Itraconazol bei Personen, die überempfindlich auf andere Azole reagieren, mit Vorsicht angewendet werden sollte.
Pädiatrische Vorsichtsmaßnahmen
Die Sicherheit und Wirksamkeit von Itraconazol bei Kindern unter 18 Jahren wurde nicht nachgewiesen. Eine begrenzte Anzahl von Patienten im Alter von 3-16 Jahren mit systemischen, nicht-meningealen Pilzinfektionen haben Itraconazol-Kapseln in einer Dosierung von 100 mg täglich ohne ungewöhnliche Nebenwirkungen erhalten. Darüber hinaus hat eine begrenzte Anzahl pädiatrischer Patienten im Alter von 6 Monaten bis 12 Jahren Itraconazol als orale Lösung in einer Dosierung von 5 mg/kg einmal täglich über 2 Wochen erhalten, ohne dass ungewöhnliche Nebenwirkungen aufgetreten sind.
Daten aus Tierversuchen haben jedoch gezeigt, dass Itraconazol bei Ratten, die Dosierungen von nur 20 mg/kg täglich erhielten (das Zweifache der empfohlenen Höchstdosis für den Menschen), Knochendefekte hervorrief. Zu den Defekten gehörten eine verringerte Aktivität der Knochenplatten, eine Ausdünnung der Zona compacta der großen Knochen und eine erhöhte Knochenbrüchigkeit. Bei einer Dosierung von 80 mg/kg täglich (das 10-fache der empfohlenen Höchstdosis für den Menschen) über einen Zeitraum von mehr als einem Jahr oder 160 mg/kg täglich (das 20-fache der empfohlenen Höchstdosis für den Menschen) führte das Arzneimittel bei einigen Ratten zu einer kleinen Zahnpulpa mit hypozellulärem Aussehen.
Während die bei Tieren beobachtete Knochentoxizität bei erwachsenen Patienten, die das Arzneimittel erhalten, bisher nicht berichtet wurde, ist die Langzeitwirkung der Itraconazol-Therapie bei Kindern nicht bekannt.
Geriatrische Vorsichtsmaßnahmen
An den klinischen Studien zur Itraconazol-Infusion nahmen nicht genügend Patienten ab 65 Jahren teil, um festzustellen, ob geriatrische Patienten anders reagieren als jüngere Patienten. Obwohl andere klinische Erfahrungen keine Unterschiede im Ansprechen gezeigt haben, sollte die Dosierung des Medikaments bei geriatrischen Patienten mit Vorsicht gewählt werden. Die größere Häufigkeit einer verminderten Leber-, Nieren- und/oder Herzfunktion sowie von Begleiterkrankungen und Arzneimitteltherapie, die bei älteren Menschen beobachtet werden, sollte ebenfalls berücksichtigt werden.
Mutagenität und Karzinogenität
Es gab keine Hinweise auf Mutagenität, als Itraconazol in ungeeigneten bakteriellen, Säugetier- und Nicht-Säugetier-Testsystemen untersucht wurde. Bei Mäusen, die 23 Monate lang orales Itraconazol in Dosierungen von bis zu 80 mg/kg täglich (etwa das Zehnfache der empfohlenen Höchstdosis für den Menschen) erhielten, gab es keine Hinweise auf Karzinogenität. Bei männlichen Ratten, die 25 mg/kg täglich erhielten (das 3,1-fache der empfohlenen Höchstdosis für den Menschen), kam es zu einem leichten Anstieg des Auftretens von Weichteilsarkomen. Diese Sarkome könnten eine Folge der Hypercholesterinämie gewesen sein, einer Reaktion auf die chronische Itraconazol-Verabreichung, die bei Ratten, nicht aber bei Hunden oder Menschen beobachtet wurde.
Ein Anstieg des Auftretens von Plattenepithelkarzinomen der Lunge wurde bei weiblichen Ratten beobachtet, die täglich 50 mg/kg Itraconazol erhielten (das 6,25-fache der empfohlenen Höchstdosis für Menschen). Obwohl das Auftreten von Plattenepithelkarzinomen in der Lunge bei unbehandelten Ratten äußerst selten ist, war die erhöhte Inzidenz in dieser Studie statistisch nicht signifikant. Kommerziell erhältliche orale Itraconazol-Lösung und Itraconazol-Injektion enthalten Hydroxypropyl-b-Cyclodextrin (HP-b-CD) als Hilfsstoff. HP-b-CD hat in Karzinogenitätsstudien an Ratten Adenokarzinome der Bauchspeicheldrüse hervorgerufen, in einer Karzinogenitätsstudie an Mäusen wurden jedoch keine ähnlichen Effekte beobachtet.
Die klinische Relevanz dieses Ergebnisses ist nicht bekannt. Auf der Grundlage von Vergleichen der Körperoberfläche wurde geschätzt, dass Patienten, die die übliche Dosierung einer handelsüblichen oralen Itraconazol-Lösung erhalten, Konzentrationen von HP-b-CD ausgesetzt wären, die dem 1,7-fachen der Exposition der niedrigsten in der Rattenstudie verwendeten Dosis entsprechen.
Ob die Ergebnisse der Tierstudien mit oral verabreichtem HP-b-CD auch für parenteral verabreichtes Itraconazol gelten, muss noch ermittelt werden.
Andere Merkmale des Patienten
Unerwünschte Wirkungen aufgrund von Wechselwirkungen mit anderen Arzneimitteln sind bei Diabetikern, die Insulin und orale Hypoglykämika verwenden, die nicht durch CYP3A4 metabolisiert werden (z. B. Tolbutamid, Gliclazid, Glibenclamid, Glipizid und Metformin), nicht zu erwarten. Die pharmakokinetischen und sicherheitsrelevanten Daten aus klinischen Studien und der Anwendungsbeobachtung wurden überprüft, um die Sicherheit von Itraconazol bei diabetischen Patienten mit Onychomykose oder Dermatomykose zu bewerten.
Die Überwachung nach der Markteinführung, einschließlich aller Berichte über unerwünschte Ereignisse bei Patienten, die Itraconazol gleichzeitig mit Insulin oder einem oralen Hypoglykämikum einnahmen, ergab 15 Berichte, die auf eine Hyperglykämie schließen lassen, und neun Berichte, die auf eine Hypoglykämie hindeuten. Bei den meisten Patienten änderte sich die antidiabetische Wirkung nicht. Aus klinischen Studien mit 189 Diabetikern, die Itraconazol zur Behandlung verschiedener Infektionen einnahmen, wurde ein einziges itraconazolbedingtes unerwünschtes Ereignis gemeldet; dabei handelte es sich um eine Verschlimmerung des Diabetes bei einem Nierentransplantationspatienten, der gleichzeitig Ciclosporin einnahm.
Itraconazol hat bei Nagetieren Anomalien in der fötalen Entwicklung verursacht und ist daher in der Schwangerschaft kontraindiziert.
Itraconazol sollte bei Patienten mit Leberfunktionsstörungen vermieden werden. Die Leberfunktion sollte überwacht werden, wenn die Behandlung länger als einen Monat dauert oder wenn Symptome auftreten, die auf eine Hepatitis hindeuten. Die Behandlung sollte abgebrochen werden, wenn eine abnorme Leberfunktion festgestellt wird.
Die Plasma-Itraconazol-Konzentrationen sollten bei Patienten mit aktiver Lebererkrankung überwacht und die Dosis gegebenenfalls angepasst werden. Bei einigen Patienten mit eingeschränkter Nierenfunktion kann ebenfalls eine Dosisanpassung erforderlich sein. In der zugelassenen Produktinformation wird davor gewarnt, dass die Anwendung von intravenösen Itraconazol-Zubereitungen, die mit Hydroxypropylbetadex formuliert sind, bei Patienten mit einer Kreatinin-Clearance von weniger als 30 ml/Minute kontraindiziert ist.
Itraconazol sollte abgesetzt werden, wenn sich eine Neuropathie entwickelt. Es sollte nicht zur Behandlung von weniger schweren Pilzinfektionen, wie Onychomykose, bei Patienten mit Anzeichen oder einer Vorgeschichte von ventrikulärer Dysfunktion, wie z.B. Herzinsuffizienz, verwendet werden. Hypochlorhydrie, die bei Patienten mit AIDS auftreten kann, kann die Absorption von Itraconazol verringern. In diesem Fall kann die Absorption verbessert werden, indem Itraconazol zusammen mit einem sauren Getränk, z. B. Cola, verabreicht wird.
Meistverkaufte Markennamen von Itraconazol in Deutschland
- Sporanox;
- Itraconazol;
- Itraconazol Bionorica.
Ähnliche Medikamente in Deutschland
In Deutschland gibt es mehrere ähnliche Medikamente wie Itraconazol. Dazu gehören Fluconazol, Voriconazol und Ketoconazol. Alle diese Medikamente sind Antimykotika, die zur Behandlung ähnlicher Pilzinfektionen eingesetzt werden, sich aber in ihrem Wirkungsspektrum und Nebenwirkungsprofil unterscheiden.
Das Medikament kann online bestellt werden und wird von einem der großen Lieferdienste in Deutschland wie DHL, Hermes, DPD, UPS, GLS oder FedEx zugestellt.
In Deutschland gibt es strenge Vorschriften für die Zulassung und den Vertrieb von Arzneimitteln. Das BfArM stellt sicher, dass alle Medikamente, einschließlich Antimykotika wie Itraconazol, die Sicherheitsstandards erfüllen, bevor sie auf den Markt kommen.
Zubereitungen
| Darreichungsform | Stärke | Markenname | Zusammensetzung/Merkmale | Hersteller |
|---|---|---|---|---|
| Kapseln zum Einnehmen | 100 mg | Sporanox® | Erhältlich in PulsePak® und normalen Packungen | Janssen |
| Orale Lösung | 10 mg/ml | Sporanox® | Enthält Hydroxypropyl-β-cyclodextrin (400 mg/mL) und Propylenglykol | Ortho Biotech |
| Parenteral zur Injektion | 10 mg/mL (250 mg Konzentrat für 200 mg intravenöse Verabreichung) | Sporanox® | Enthält Hydroxypropyl-β-cyclodextrin (400 mg/mL), Propylenglykol und 0,9% Natriumchlorid als Verdünnungsmittel; enthält ein gefiltertes Infusionsset | Ortho Biotech |
Andere Markennamen in verschiedenen Ländern
| Land | Markennamen |
|---|---|
| Argentinien | ITC, Itrac, Micotenk, Nitridazol, Panastat, Salimidin, Sporanox |
| Australien | Sporanox |
| Österreich | Itrabene, Sporanox |
| Belgien | Sporanox |
| Brasilien | Es-Tiranox, Fungonax, Itracotan, Itrahexal-H, Itranax, Itraspor, Itrazol, Neo Itrax, Sporanox, Spozol, Tracnox, Traconal, Traconax, Tracozon, Trana-zol, Tratzol, Traxonol |
| Kanada | Sporanox |
| Chile | Itodal, Sporanox, Teramic |
| Tschechische Republik | Cladostad, Prokanazol, Sporanox |
| Dänemark | Niddazol, Sporanox |
| Finnland | Sporanox |
| Frankreich | Sporanox |
| Deutschland | Canifug, Itra, Itracol, Sempera, Siros |
| Griechenland | Assosept-S, Bevonazol, Brovicton, Deratil, Etrel, Flunol, Idranox, Isoflon, Itrabest, Itracon, Itraconal, Itralfa, Itraviron, Itrazol, Laverio, Lorenzol, Mesmor, Micronazol, Prominox, Soprazon, Sporanox, Sporizol, Stas, Sterginox, Zetilox |
| Hongkong | Aranox, Quali-Itrazol, Sporanox |
| Ungarn | Cladostad, Omicral, Orungal |
| Indien | Candistat, Canditral, Itracan |
| Indonesien | Forcanox, Fungitrazol, Furolnok, Itzol, Nufatrac, Sporacid, Sporanox, Spyrocon, Trachon, Unitrac, Zitrazol |
| Irland | Sporanox |
| Israel | Itranol, Sporanox |
| Italien | Sporanox, Trazer, Triasporin |
| Malaysia | Canditral, Inox, Sporanox, Unitrac |
| Mexiko | Carexan, Conamed, Congox, Derusil, Ergospharma, Fitocyd, Fulzoltec, Fuzoltec, Imazol, Iqcona, Isoporum, Isox, Itranax, Lozartil, Rixtal, Seritral, Silicsan, Sinozol, Solmavin, Sporanox, Steitraz, Trax, Z-Fin, Zolken |
| Die Niederlande | Trisporal |
| Norwegen | Sporanox |
| Neuseeland | Sporanox |
| Philippinen | Sporanox |
| Polen | Orungal, Trioxal |
| Portugal | Sporanox |
| Russland | Irunin, Orungal, Orungamin, Orunit, Rumycoz |
| Süd-Afrika | Adco-Sporozol, Sporanox |
| Singapur | Canditral, Sporanox |
| Spanien | Canadiol, Hongoseril, Oromic, Sporanox |
| Schweden | Sporanox |
| Schweiz | Sporanox |
| Thailand | Canditral, Icona, Itra, Itracon, Norspor, Spazol, Sporal, Sporlab, Spornar |
| Türkei | Funit, Itraspor, Sporex |
| Vereinigtes Königreich | Sporanox |
| Vereinigte Staaten | Sporanox |
| Venezuela | Fungosin, Sporanox |
Mehrere Wirkstoffe
- Mexiko: Sepia Sporasec
- Venezuela: Sporasec
Sie können dieses Medikament online bestellen und mit den drei großen deutschen Online-Zahlungssystemen Klarna, giropay und Sepa-Lastschriftverfahren bezahlen.

