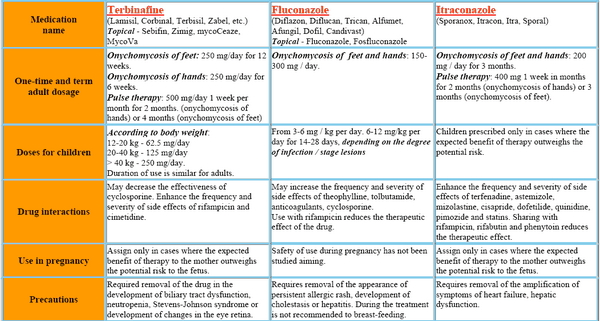
L’itraconazole peut être utilisé pour traiter diverses infections fongiques superficielles, notamment les dermatophytoses, le pityriasis versicolor et les formes muqueuses et cutanées de candidose. Il est également efficace chez les patients atteints d’infections sous-cutanées, telles que la chromoblastomycose, la sporotrichose et certaines formes de phaeohyphomycose. Il est devenu le médicament de choix pour les formes non mortelles de blastomycose et d’histoplasmose et constitue une alternative à l’amphotéricine B pour l’aspergillose invasive. En France, l’Itraconazole est disponible sous plusieurs marques, dont Sporanox et Onmel. Ces médicaments sont largement utilisés pour le traitement des infections fongiques et sont prescrits par les médecins en fonction de la pathologie à traiter.
Nomenclature du médicament
Classes thérapeutiques de l’itraconazole
Agents antifongiques, antifongiques, agents antiprotozoaires, antiprotozoaires.
Pharmacopée européenne, 6e édition (Itraconazole)
Poudre blanche ou presque blanche. Pratiquement insoluble dans l’eau, légèrement soluble dans l’alcool, librement soluble dans le dichlorométhane, peu soluble dans le tétrahydrofurane. Protéger de la lumière.
L’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM) a approuvé l’utilisation de l’Itraconazole dans le traitement de diverses infections fongiques dans le pays.
Pharmacocinétique
L’absorption de l’itraconazole par le tractus gastro-intestinal est incomplète (environ 55 %), mais elle est améliorée si le médicament est administré avec de la nourriture. L’administration orale d’une seule gélule de 100 mg produit des concentrations sériques maximales comprises entre 0,1 et 0,2 mg/l environ 2 à 4 heures plus tard. Des concentrations plus élevées sont obtenues après des doses répétées, mais il existe des variations marquées entre les individus. Comme pour le kétoconazole, on observe une augmentation disproportionnée des concentrations sanguines avec l’augmentation de la dose. Les concentrations sériques sont nettement réduites en cas d’altération de la production d’acide gastrique.
Des concentrations sanguines beaucoup plus élevées (jusqu’à 1,0-1,5 mg/1) ont été atteintes chez des patients atteints du SIDA et des personnes neutropéniques après l’administration d’une dose de 5 mg/kg de la solution orale d’itraconazole pendant 1 à 2 semaines. Cette formulation est mieux absorbée si elle est administrée sans nourriture.
Comme la plupart des autres antifongiques azolés, l’itraconazole se lie fortement aux protéines, à plus de 99 % dans le sérum humain. Par conséquent, les concentrations du médicament dans les fluides corporels tels que le LCR sont minimes. En revanche, les concentrations du médicament dans les tissus, tels que les poumons, le foie et les os, sont deux à trois fois plus élevées que dans le sérum. Des concentrations élevées d’itraconazole sont également présentes dans la couche cornée en raison de la sécrétion du médicament dans le sébum. On a constaté que l’itraconazole persistait dans la peau pendant 2 à 4 semaines après la fin d’un traitement de 4 semaines. Il persiste dans les ongles des orteils jusqu’à 6 mois après la fin d’un traitement de 3 mois, mais les niveaux dans les ongles des mains diminuent environ 3 mois après la fin du traitement.
Moins de 0,03 % de la dose administrée d’itraconazole est excrétée sous forme inchangée dans les urines, mais jusqu’à 18 % sont éliminés dans les fèces sous forme inchangée.
Études et essais cliniques en France
Plusieurs essais cliniques ont été menés en France pour évaluer l’efficacité et la sécurité de l’itraconazole, en particulier dans le traitement des infections fongiques telles que l’aspergillose et la candidose. L’une de ces études a porté sur des patients dont le système immunitaire était affaibli, comme ceux atteints du VIH/sida, et a montré que l’itraconazole était efficace pour réduire les infections fongiques, bien que certains patients aient ressenti de légers effets secondaires tels qu’une gêne gastro-intestinale.
Un autre essai a examiné l’utilisation du médicament pour les infections fongiques chroniques chez les personnes immunocompétentes, et a montré des résultats positifs dans la réduction des taux d’infection avec des réactions indésirables minimes. Ces informations ont permis de mieux comprendre comment cet agent antifongique peut être utilisé en toute sécurité dans des contextes cliniques pour différentes populations de patients en France.
Le Dr Pierre Leclerc, spécialiste renommé des maladies infectieuses à Paris, a publié des articles sur l’efficacité de l’itraconazole dans le traitement des infections fongiques chez les patients immunodéprimés. Le Dr Isabelle Dufresne, dermatologue à Lyon, a également contribué à la recherche sur les applications topiques de l’itraconazole pour les affections fongiques de la peau.
Utilisation
L’itraconazole est un médicament délivré uniquement sur ordonnance en France. Les patients doivent l’obtenir sur ordonnance d’un professionnel de santé agréé.
Les gélules d’itraconazole IV et orales sont utilisées pour traiter les infections fongiques systémiques chez les patients immunodéprimés et immunocompétents. Ces infections comprennent la blastomycose (pulmonaire et extrapulmonaire), l’histoplasmose (y compris la maladie pulmonaire cavitaire chronique et la maladie non méningée disséminée) et l’aspergillose (pulmonaire et extrapulmonaire chez les patients qui ne répondent pas à l’amphotéricine B ou qui ne la tolèrent pas).
La solution orale d’itraconazole (mais pas les gélules d’itraconazole) est utilisée pour le traitement de la candidose oropharyngée et œsophagienne. L’itraconazole (administré d’abord par voie IV, puis par la solution orale d’itraconazole) est utilisé comme traitement antifongique empirique chez les patients neutropéniques fébriles. Les gélules orales d’itraconazole sont utilisées chez les personnes immunocompétentes pour le traitement du tinea unguium (onychomycose) de l’ongle de l’orteil et/ou de l’ongle du doigt causé par des dermatophytes.

L’itraconazole est également utilisé par voie orale pour la prévention des infections fongiques graves (par exemple, coccidioïdomycose, cryptococcose, histoplasmose, candidose mucocutanée) chez les patients infectés par le virus de l’immunodéficience humaine (VIH). Avant l’instauration d’un traitement par itraconazole IV ou par gélules d’itraconazole par voie orale pour le traitement des infections fongiques systémiques, il convient d’obtenir des échantillons appropriés pour la culture fongique et d’autres études de laboratoire pertinentes (montage humide, histopathologie, sérologie) afin d’isoler et d’identifier le(s) organisme(s) responsable(s). Le traitement par l’itraconazole peut être instauré dans l’attente des résultats de ces tests in vitro ; toutefois, dès que les résultats sont disponibles, le traitement doit être ajusté en conséquence. Avant l’instauration des gélules orales d’itraconazole pour le traitement de l’onychomycose, des échantillons d’ongles appropriés pour des études microbiologiques (par exemple, préparation d’hydroxyde de potassium [KOH], culture fongique, biopsie de l’ongle) doivent être prélevés pour confirmer le diagnostic.
Aspergillose
L’itraconazole est utilisé dans le traitement de l’aspergillose pulmonaire et extrapulmonaire chez les patients intolérants ou réfractaires à l’amphotéricine B IV. L’amphotéricine B IV est généralement considérée comme le traitement de choix de l’aspergillose invasive, en particulier pour les infections graves et mettant en jeu le pronostic vital, et l’itraconazole est un agent alternatif. Chez un nombre limité de patients atteints d’aspergillose invasive qui n’ont pas répondu ou n’ont pas pu tolérer l’amphotéricine B IV, les capsules d’itraconazole par voie orale (200-400 mg par jour pendant une durée médiane de traitement de 3-4 mois) se sont avérées efficaces en tant que traitement de deuxième intention.
Blastomycose
L’itraconazole est utilisé dans le traitement de la blastomycose pulmonaire et extrapulmonaire causée par Blastomyces dermatitidis. Bien que les gélules d’itraconazole par voie orale et l’amphotéricine B par voie IV soient considérées comme des médicaments de choix pour le traitement de la blastomycose, l’amphotéricine B est préférée pour le traitement des infections graves, en particulier celles qui touchent le SNC. L’amphotéricine B IV est aussi généralement préférée pour le traitement initial de la blastomycose présumée chez les patients immunodéprimés, y compris les personnes infectées par le VIH. De nombreux cliniciens considèrent l’itraconazole oral comme le médicament de choix pour le traitement de la blastomycose non méningée, ne menaçant pas le pronostic vital, y compris les infections disséminées légères à modérées sans atteinte du SNC, et recommandent également ce médicament pour le traitement de suivi des patients souffrant d’infections plus graves après qu’une réponse initiale a été obtenue avec l’amphotéricine B par voie intraveineuse.
Des échecs thérapeutiques ont été rapportés lorsqu’un antifongique oral (par exemple, le kétoconazole) a été utilisé pour traiter une blastomycose cutanée ou pulmonaire chez des patients qui présentaient une atteinte asymptomatique ou subclinique du SNC au moment du diagnostic initial. Il convient d’en tenir compte lors du choix d’un agent antifongique pour les patients atteints de blastomycose. Certains cliniciens affirment que les antifongiques azolés ne doivent pas être utilisés pour le traitement primaire des patients atteints de blastomycose du SNC.
Histoplasmose
L’itraconazole est utilisé dans le traitement de l’histoplasmose, y compris la maladie pulmonaire cavitaire chronique et la maladie non méningée disséminée. L’amphotéricine B par voie IV et les capsules d’itraconazole par voie orale sont considérées comme des médicaments de choix pour le traitement de l’histoplasmose. Cependant, l’amphotéricine B IV est généralement préférée pour le traitement initial de l’histoplasmose sévère, menaçant le pronostic vital, en particulier chez les patients immunodéprimés tels que ceux atteints d’une infection par le VIH.
L’itraconazole par voie orale est généralement utilisé dans le traitement initial des infections légères à modérées (par exemple, chez les patients qui ne nécessitent pas d’hospitalisation) ou comme traitement de suivi dans le traitement des infections graves après une réponse à l’amphotéricine B. L’itraconazole a été utilisé pour le traitement de l’histoplasmose disséminée chez les patients atteints d’une infection par le VIH.
Le fabricant déclare que les données provenant d’un nombre limité de patients indiquent que le taux de réponse de l’histoplasmose au traitement par l’itraconazole chez les personnes infectées par le VIH est similaire à celui des patients non infectés par ce virus. Cependant, l’évolution clinique de l’histoplasmose chez les personnes infectées par le VIH est généralement plus grave et nécessite habituellement un traitement d’entretien à long terme pour prévenir les rechutes. Des études sont en cours pour mieux établir la sécurité et l’efficacité du médicament dans le traitement de cette infection chez les personnes infectées par le VIH, y compris la recherche de la posologie et de la durée optimales du traitement d’entretien. L’itraconazole par voie orale est considéré comme le médicament de choix pour la prophylaxie primaire et le traitement suppressif ou d’entretien à long terme (prophylaxie secondaire) afin de prévenir la récurrence ou la rechute de l’histoplasmose chez les personnes infectées par le VIH. (Voir Utilisations : Prévention des infections fongiques chez les personnes infectées par le VIH)
Candidose oropharyngée et œsophagienne
Étant donné que les effets topiques et l’exposition au médicament peuvent être plus importants avec la solution orale qu’avec les capsules d’itraconazole, seule la solution orale d’itraconazole doit être utilisée pour le traitement de la candidose oropharyngée et œsophagienne. Dans deux études contrôlées menées chez des patients atteints de candidose oropharyngée (92 % étaient infectés par le VIH), une réponse clinique (définie comme une guérison ou une amélioration) a été obtenue chez 71 à 84 % des patients recevant la solution orale d’itraconazole. Certaines données indiquent que la solution orale d’itraconazole est au moins aussi efficace que les comprimés oraux de fluconazole et peut être plus efficace que les pastilles orales de clotrimazole pour le traitement de la candidose oropharyngée. La solution orale d’itraconazole s’est avérée efficace pour traiter la candidose oropharyngée chez certains patients, y compris des personnes infectées par le VIH, qui n’ont pas répondu au fluconazole oral.
Sporotrichose
Ce médicament est utilisé pour traiter la sporotrichose. Bien que l’itraconazole oral puisse être efficace chez les patients atteints de sporotrichose pulmonaire ou disséminée légère à modérée, l’amphotéricine B IV est le médicament de choix pour le traitement initial des infections graves, mettant en jeu le pronostic vital, et en cas d’atteinte du système nerveux central. L’itraconazole par voie orale est généralement considéré comme le médicament de choix pour le traitement des sporotrichoses cutanées, lymphocutanées, pulmonaires ou ostéoarticulaires légères et pour le traitement de suivi des infections plus graves après qu’une réponse a été obtenue avec l’amphotéricine B par voie intraveineuse.
Étant donné que la sporotrichose chez les patients immunodéprimés (par exemple, les personnes infectées par le VIH) est particulièrement agressive et difficile à traiter, l’amphotéricine B IV est probablement le médicament de choix pour le traitement initial chez ces patients ; cependant, des échecs thérapeutiques se produisent. Certains cliniciens recommandent que les personnes infectées par le VIH qui ont été traitées pour une sporotrichose reçoivent de l’itraconazole par voie orale dans le cadre d’un traitement suppressif ou d’entretien à vie afin de prévenir les rechutes. Cette prophylaxie n’est pas abordée dans les lignes directrices actuelles de l’US Public Health Service et de l’Infectious Diseases Society of America (USPHS/IDSA) pour la prévention des infections opportunistes chez les personnes infectées par le VIH.
Onychomycose
Les gélules d’itraconazole administrées par voie orale sont utilisées chez les personnes immunocompétentes pour le traitement de l’onychomycose des ongles des pieds (avec ou sans atteinte des ongles des mains) et de l’onychomycose des ongles des mains causée par des dermatophytes (tinea unguium).
Avant l’administration des gélules d’itraconazole pour le traitement de l’onychomycose, des échantillons d’ongles appropriés doivent être prélevés pour des études microbiologiques (par exemple, préparation d’hydroxyde de potassium [KOH], culture fongique, biopsie de l’ongle) afin de confirmer le diagnostic. Dans des études en double aveugle, contrôlées par placebo, menées chez des patients atteints d’onychomycose des ongles d’orteil, l’itraconazole oral (200 mg sous forme de gélules administrées une fois par jour pendant 12 semaines consécutives) a entraîné une guérison mycologique chez 54 % des patients ; 35 % ont été considérés comme un succès global (guérison mycologique et atteinte unguéale claire ou minime avec diminution significative des signes) et 14 % ont obtenu une guérison mycologique et une guérison clinique (disparition de tous les signes, avec ou sans déformation résiduelle de l’ongle).
La durée moyenne de la réussite globale était d’environ 10 mois ; cependant, 21 % des patients considérés comme ayant obtenu une réussite globale ont connu une rechute de l’onychomycose. Dans une étude en double aveugle, contrôlée par placebo, menée chez des patients atteints d’onychomycose des ongles, l’itraconazole oral administré selon un schéma posologique pulsé (200 mg en gélules deux fois par jour pendant la première semaine, pas d’itraconazole pendant les semaines 2 à 4, et 200 mg en gélules deux fois par jour pendant la cinquième semaine) a entraîné une guérison mycologique chez 61 % des patients ; 56 % ont été considérés comme ayant obtenu un succès global et 47 % ont obtenu une guérison mycologique et une guérison clinique. Le délai moyen de réussite globale était d’environ 5 mois ; il n’y a pas eu de rechute chez les patients considérés comme ayant obtenu une réussite globale.
Paracoccidioïdomycose
Les gélules orales d’itraconazole sont utilisées dans le traitement de la paracoccidioïdomycose (blastomycose sud-américaine) causée par Paracoccidioides brasiliensis et sont considérées comme un médicament de choix pour le traitement de cette infection. Bien que le schéma thérapeutique le plus efficace pour le traitement de la paracoccidioïdomycose chez les personnes infectées par le VIH n’ait pas été identifié, certains cliniciens suggèrent que ces patients reçoivent un traitement initial à base d’amphotéricine B IV, et qu’un agent moins toxique (par exemple, les gélules orales d’itraconazole) soit utilisé, gélules orales d’itraconazole, cotrimoxazole) peut ensuite être utilisé pour un traitement suppressif à long terme en prophylaxie contre la récurrence ou la rechute ; cette prophylaxie n’est pas abordée dans les lignes directrices actuelles recommandées par l’USPHS/IDSA pour la prévention des infections opportunistes chez les personnes infectées par le VIH.
Coccidioïdomycose et cryptococcose
Bien qu’elles ne soient pas considérées comme un médicament de premier choix, les capsules orales d’itraconazole sont utilisées comme agent alternatif pour le traitement de la coccidioïdomycose ou de la cryptococcose. Les capsules d’itraconazole sont également utilisées comme agent alternatif pour la prophylaxie primaire de la cryptococcose ou pour le traitement suppressif ou d’entretien visant à prévenir la récurrence ou la rechute de la coccidioïdomycose ou de la cryptococcose chez les personnes infectées par le VIH.
Chromomycose
Les gélules d’itraconazole administrées par voie orale ont été utilisées avec un certain succès dans le traitement de la chromomycose (chromoblastomycose) causée par divers champignons dématiés (par exemple, Cladosporium, Exophiala, Fonsecaea, Phialophora).
Basidiobolomycose
L’itraconazole par voie orale a été utilisé chez un nombre limité de patients pour traiter la basidiobolomycose digestive, une zygomycose causée par Basidiobolus ranarum. B. ranarum a été isolé dans le monde entier à partir de végétaux et de sols en décomposition et dans le tractus gastro-intestinal de reptiles, d’amphibiens, de poissons et de chauves-souris insectivores (y compris aux États-Unis). La basidiobolomycose survient le plus souvent dans les régions tropicales et subtropicales telles que l’Afrique de l’Est et de l’Ouest, et l’infection se manifeste généralement par des nodules sous-cutanés indolores des membres, du tronc ou des fesses à la suite d’une inoculation traumatique.
Les infections gastro-intestinales sont extrêmement rares et peuvent résulter de l’ingestion de sol contaminé (en particulier près des rivières ou des lacs) ou de fruits ou de légumes contaminés par de la terre ou des excréments de reptiles ou d’amphibiens infectés. Entre avril 1994 et mai 1999, 7 cas de basidiobolomycose gastro-intestinale ont été identifiés en Arizona. La plupart des cas de basidiobolomycose gastro-intestinale ont été traités avec succès par l’itraconazole oral (400 mg par jour pendant 3 à 19 mois) après une résection chirurgicale partielle du tractus gastro-intestinal ; cependant, on ne sait pas si une réponse clinique aurait été obtenue si l’itraconazole avait été utilisé seul sans intervention chirurgicale. Bien que le kétoconazole ait également été rapporté comme étant efficace chez au moins un patient, l’amphotéricine B s’est avérée inefficace pour le traitement de la basidiobolomycose gastro-intestinale chez plusieurs patients.
Traitement empirique chez les patients neutropéniques fébriles
L’itraconazole (administré d’abord par voie IV, puis par une solution orale d’itraconazole) est utilisé pour le traitement empirique des infections fongiques présumées chez les patients neutropéniques fébriles. La sécurité et l’efficacité de l’itraconazole dans cette indication ont été évaluées dans une étude ouverte et randomisée chez des adultes neutropéniques fébriles atteints d’hémopathies malignes ; les patients ont reçu soit de l’itraconazole (200 mg IV deux fois par jour pendant 2 jours, puis 200 mg IV une fois par jour du 3e au 14e jour, suivi d’une solution orale d’itraconazole 200 mg deux fois par jour pour terminer jusqu’à 28 jours de traitement), soit de l’amphotéricine B IV conventionnelle (0,7-1 mg/kg par jour pendant jusqu’à 28 jours). Le taux de succès thérapeutique (défini comme la survie du patient avec résolution de la fièvre et de la neutropénie dans les 28 jours de traitement, l’absence d’infections fongiques émergentes, l’utilisation du médicament à l’étude sans interruption prématurée pour cause de toxicité ou de manque d’efficacité, et le traitement pendant 3 jours ou plus) était de 47% pour l’itraconazole et de 38% pour l’amphotéricine B (analyse en intention de traiter). Bien que le taux de réponse global ait été plus élevé chez les patients recevant de l’itraconazole, plus de patients recevant de l’itraconazole ont arrêté le traitement en raison d’une fièvre persistante ou ont changé de traitement antifongique en raison d’une fièvre, et plus de patients recevant de l’amphotéricine B ont arrêté le traitement en raison d’une intolérance.
Prévention des infections fongiques chez les personnes infectées par le VIH
L’itraconazole par voie orale est utilisé chez certains patients infectés par le VIH en prophylaxie primaire contre la cryptococcose ou l’histoplasmose et en traitement suppressif ou d’entretien à long terme (prophylaxie secondaire) pour prévenir la récurrence ou la rechute de la coccidioïdomycose, de la cryptococcose, de l’histoplasmose ou de la candidose cutanéo-muqueuse.
Le groupe de travail sur la prévention des infections opportunistes de l’USPHS/IDSA a établi des lignes directrices pour la prévention des infections opportunistes, y compris les infections fongiques, chez les personnes infectées par le VIH. Ces lignes directrices comprennent des recommandations concernant la prévention de l’exposition aux agents pathogènes opportunistes, la prévention des premiers épisodes de la maladie et la prévention de la récurrence de la maladie. L’USPHS/IDSA déclare que la prophylaxie primaire pour prévenir les premiers épisodes de candidose mucocutanée chez les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH n’est pas recommandée.
Bien que la prophylaxie primaire de routine pour prévenir les premiers épisodes de coccidioïdomycose, de cryptococcose ou d’histoplasmose chez les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH ne soit pas recommandée, l’USPHS/IDSA indique qu’une prophylaxie primaire contre la cryptococcose ou l’histoplasmose peut être envisagée chez certaines personnes sélectionnées. L’USPHS/IDSA recommande que les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH qui ont suivi un traitement initial pour une coccidioïdomycose, une cryptococcose ou une histoplasmose documentée reçoivent un traitement suppressif ou d’entretien à long terme (prophylaxie secondaire) pour prévenir la récurrence ou la rechute de ces infections fongiques.
En outre, l’USPHS/IDSA indique que les personnes infectées par le VIH qui présentent des récidives fréquentes ou graves de candidose mucocutanée peuvent bénéficier d’un traitement suppressif ou d’entretien à long terme (prophylaxie secondaire). En raison des inquiétudes concernant l’utilisation d’antifongiques azolés oraux pendant la grossesse, l’itraconazole ne doit pas être utilisé en prophylaxie primaire ou en traitement chronique de suppression ou d’entretien chez les femmes enceintes. Si une femme tombe enceinte alors qu’elle reçoit de l’itraconazole à titre prophylactique et décide de poursuivre sa grossesse, le médicament doit être interrompu.
Des mesures contraceptives efficaces sont recommandées pour toutes les femmes infectées par le VIH qui reçoivent un antifongique azolé par voie orale dans le cadre d’un traitement suppressif. L’amphotéricine B IV conventionnelle peut être l’agent préféré si un traitement suppressif ou d’entretien à long terme contre la coccidioïdomycose, la cryptococcose ou l’histoplasmose est indiqué chez une femme enceinte infectée par le VIH, en particulier au cours du premier trimestre.
Prophylaxie primaire
La sécurité et l’efficacité de l’itraconazole oral en prophylaxie primaire des infections fongiques graves chez les personnes infectées par le VIH ont été évaluées dans le cadre d’une étude prospective, randomisée, contrôlée par placebo, menée chez 149 patients atteints d’une infection avancée par le VIH. La prophylaxie a échoué chez 19 % des patients recevant de l’itraconazole par voie orale (200 mg une fois par jour) et chez 29 % des patients recevant un placebo. Les échecs de la prophylaxie liés à des infections fongiques invasives (histoplasmose, cryptococcose, aspergillose) ont été plus fréquents chez les patients recevant le placebo que chez ceux recevant l’itraconazole ; cependant, l’incidence des échecs de la prophylaxie dus à une candidose muqueuse récurrente ou réfractaire a été similaire dans les deux groupes. Bien que la prophylaxie par l’itraconazole ait significativement retardé le délai d’apparition de l’histoplasmose et de la cryptococcose, aucun avantage en termes de survie n’a été démontré chez les patients traités par ce médicament.
Cryptococcose
L’USPHS/IDSA indique que, bien que la prophylaxie primaire de routine contre la cryptococcose ne soit pas recommandée, elle peut être envisagée chez les adultes et les adolescents infectés par le VIH dont le nombre de lymphocytes T CD4 est inférieur à 50/mm3 et chez les nourrissons et les enfants souffrant d’immunosuppression sévère (selon les critères ajustés à l’âge). La prophylaxie systématique n’est pas recommandée en raison de la fréquence relativement faible des maladies cryptococciques, de l’absence de preuves d’un bénéfice de survie associé à la prophylaxie, ainsi que d’autres préoccupations (par exemple, la possibilité d’interactions médicamenteuses, le risque de développement d’une résistance, les considérations de coût).
La nécessité d’une prophylaxie primaire ou d’une thérapie suppressive contre d’autres infections fongiques (coccidioïdomycose, histoplasmose, candidose mucocutanée) doit être prise en compte lors de la décision concernant la prophylaxie contre la cryptococcose. Le dépistage systématique de l’antigène cryptococcique sérique chez les personnes asymptomatiques n’est pas recommandé en raison de la faible probabilité que les résultats influencent les décisions cliniques. Les personnes infectées par le VIH ne peuvent pas éviter complètement l’exposition à Cryptococcus neoformans ; il n’existe aucune preuve que l’exposition aux déjections de pigeons soit associée à un risque accru de cryptococcose. Le fluconazole oral est l’agent de choix pour la prophylaxie primaire contre la cryptococcose chez les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH ; l’itraconazole oral (sous forme de gélules) est considéré comme une alternative.
Histoplasmose
L’USPHS/IDSA indique qu’une prophylaxie primaire contre l’histoplasmose peut être envisagée chez les adultes ou les adolescents infectés par le VIH dont le nombre absolu de lymphocytes T auxiliaires/inducteurs (CD4 , T4 ) inférieur à 100/mm3 qui présentent un risque particulièrement élevé d’exposition à Histoplasma capsulatum en raison d’une exposition professionnelle ou qui vivent dans une communauté présentant un taux hyperendémique d’histoplasmose (au moins 10 cas/100 patients-années) et peut également être envisagée pour les nourrissons ou les enfants infectés par le VIH présentant une immunosuppression sévère (telle que définie par les critères ajustés à l’âge) qui vivent dans des zones endémiques pour l’histoplasmose.
Lorsqu’ils décident d’utiliser une prophylaxie primaire contre l’histoplasmose chez ces personnes infectées par le VIH, les cliniciens doivent tenir compte de l’incidence locale de l’histoplasmose, de la possibilité d’interactions médicamenteuses, de la toxicité, du développement d’une résistance, du coût et de la nécessité d’une prophylaxie contre d’autres infections fongiques (par exemple, candidose, cryptococcose).
Les tests cutanés de routine avec l’histoplasmine ou les tests sérologiques pour les anticorps ou les antigènes de l’histoplasmose chez les personnes infectées par le VIH qui vivent dans des zones endémiques pour l’histoplasmose ne sont pas prédictifs de la maladie et ne sont pas recommandés. Bien que les personnes infectées par le VIH qui vivent dans des zones d’endémie de l’histoplasmose ou qui s’y rendent ne puissent pas éviter complètement l’exposition à H. capsulatum, celles dont le nombre de lymphocytes T CD4 est inférieur à 200/mm3 devraient éviter les activités connues pour être associées à un risque accru (par exemple, créer de la poussière en travaillant avec des sols de surface ; nettoyer des poulaillers fortement contaminés par des fientes ; remuer le sol sous des sites de gîte d’oiseaux ; nettoyer, remodeler ou démolir de vieux bâtiments ; explorer des grottes). L’itraconazole par voie orale (sous forme de gélules) est l’agent de choix pour la prophylaxie primaire contre l’histoplasmose chez les adultes, les adolescents ou les enfants infectés par le VIH. L’USPHS/IDSA ne formule aucune recommandation concernant une alternative à l’itraconazole.
Prévention des récidives
Coccidioïdomycose : Pour le traitement suppressif ou d’entretien à long terme (prophylaxie secondaire) visant à prévenir la récurrence ou la rechute chez les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH dont la coccidioïdomycose a été traitée de manière adéquate, l’USPHS/IDSA recommande le fluconazole par voie orale comme médicament de choix et l’amphotéricine B par voie IV ou l’itraconazole par voie orale (sous forme de capsules) comme alternatives. Le traitement suppressif ou d’entretien à long terme pour la prophylaxie contre la récurrence ou la rechute de la coccidioïdomycose chez les personnes infectées par le VIH est généralement poursuivi à vie. Bien que les personnes infectées par le VIH qui reçoivent une prophylaxie antifongique suppressive contre la coccidioïdomycose puissent présenter un faible risque de récurrence de cette infection fongique si leur nombre de lymphocytes T CD4 augmente pour atteindre plus de 100/mm3 pendant qu’elles reçoivent un traitement antirétroviral combiné puissant, l’USPHS/IDSA déclare que les données sont insuffisantes à ce jour pour justifier une recommandation concernant l’arrêt de la prophylaxie chez ces personnes.
Cryptococcose : Pour le traitement suppressif ou d’entretien à long terme (prophylaxie secondaire) visant à prévenir la récurrence ou la rechute chez les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH et atteints d’une cryptococcose documentée qui a été traitée de manière adéquate, l’USPHS/IDSA recommande le fluconazole par voie orale comme médicament de choix et l’amphotéricine B par voie IV ou l’itraconazole par voie orale (sous forme de capsules) comme alternatives.
Le traitement de suppression ou d’entretien (prophylaxie secondaire) visant à prévenir la récurrence ou la rechute de la cryptococcose chez les personnes infectées par le VIH est généralement poursuivi à vie, à moins qu’une thérapie antirétrovirale puissante n’ait entraîné une récupération immunitaire.
Histoplasmose : Pour le traitement suppressif ou d’entretien à long terme visant à prévenir la récurrence ou la rechute chez les adultes, les adolescents, les nourrissons et les enfants infectés par le VIH dont l’histoplasmose a été traitée de manière adéquate, l’USPHS/IDSA recommande l’itraconazole par voie orale (sous forme de capsules) comme médicament de choix et l’amphotéricine B par voie intraveineuse comme alternative. Le traitement suppressif ou d’entretien à long terme contre l’histoplasmose chez les personnes infectées par le VIH est généralement poursuivi à vie. Bien que les patients recevant une prophylaxie antifongique suppressive puissent présenter un faible risque de récurrence de l’histoplasmose si leur nombre de lymphocytes T CD4 augmente pour atteindre plus de 100/mm3 pendant qu’ils reçoivent un traitement antirétroviral combiné puissant, l’USPHS/IDSA déclare que les données sont insuffisantes à ce jour pour justifier une recommandation concernant l’arrêt de la prophylaxie chez ces personnes.
Candidose mucocutanée : L’USPHS/IDSA recommande un traitement suppressif ou d’entretien à long terme pour les adultes et les adolescents ayant des antécédents avérés de candidose œsophagienne (en particulier en cas d’épisodes multiples), compte tenu du risque de développement de souches résistantes de Candida. En outre, l’USPHS/IDSA recommande une thérapie suppressive pour les nourrissons et les enfants atteints de candidose mucocutanée sévère et récurrente, en particulier ceux atteints de candidose œsophagienne.
Bien que de nombreux experts ne recommandent pas de traitement suppressif à long terme des candidoses oropharyngées ou vulvovaginales récurrentes, ils ne recommandent pas, pour les mêmes raisons, de prophylaxie primaire contre la candidose. L’USPHS/IDSA indique qu’un traitement suppressif contre la candidose peut être envisagé chez les personnes infectées par le VIH présentant des récidives fréquentes ou graves de ces infections.
Cependant, plusieurs facteurs doivent être pris en compte avant d’envisager un tel traitement, notamment l’impact des récidives sur le bien-être et la qualité de vie du patient, la nécessité d’une prophylaxie contre d’autres infections fongiques, le coût de la prophylaxie, la toxicité des médicaments, les interactions médicamenteuses et le risque de développement d’une résistance aux médicaments parmi les Candida et d’autres champignons. Si un traitement suppressif ou d’entretien à long terme est indiqué chez les adultes, les adolescents, les nourrissons ou les enfants infectés par le VIH qui présentent des récidives fréquentes ou graves de candidose oropharyngée, œsophagienne ou vaginale, l’USPHS/IDSA recommande le fluconazole par voie orale comme médicament de choix et l’itraconazole (administré sous forme de solution buvable) comme alternative.
Administration
L’itraconazole est administré par voie orale ou par perfusion IV.
En France, l’itraconazole est disponible sous plusieurs formes : gélules orales (100 mg), solution buvable (10 mg/ml) et comprimés (Onmel). Le dosage et la forme dépendent de l’infection à traiter et de l’état du patient.
Administration orale
La biodisponibilité de l’itraconazole oral varie selon que le médicament est administré sous forme de gélules ou de solution orale, et le fabricant précise que ces préparations ne doivent pas être utilisées de manière interchangeable. La solution orale d’itraconazole (et non les gélules d’itraconazole) est indiquée pour le traitement de la candidose oropharyngée ou œsophagienne. Alors que la solution orale d’itraconazole doit être administrée sans nourriture si possible, les capsules d’itraconazole doivent être administrées au cours d’un repas complet pour assurer une absorption maximale du médicament. La possibilité d’une diminution de l’absorption gastro-intestinale du médicament chez les patients souffrant d’hypochlorhydrie, qui a été rapportée chez les personnes infectées par le VIH, doit être prise en compte.
Perfusion IV
L’itraconazole injectable disponible dans le commerce doit être dilué avant la perfusion IV. Le contenu entier d’une ampoule contenant de l’itraconazole injectable (250 mg) doit être ajouté au diluant pour injection de chlorure de sodium à 0,9 % (50 ml) fourni par le fabricant afin d’obtenir une solution contenant 3,33 mg/ml dans un volume résultant de 75 ml.
Pour garantir une sécurité et une efficacité maximales, la solution d’itraconazole doit être préparée et administrée correctement. Le rapport approprié entre l’itraconazole et le diluant doit être utilisé et une concentration finale de 3,33 mg/ml doit être maintenue pour obtenir un mélange stable et éviter la formation d’un précipité.
Lorsque la solution et le récipient le permettent, l’Itraconazole injectable et les solutions diluées du médicament doivent faire l’objet d’une inspection visuelle pour vérifier l’absence de particules et de décoloration avant l’administration. Pour obtenir une dose de 200 mg d’itraconazole, la solution diluée doit être mélangée doucement, puis 15 ml doivent être prélevés et jetés. Les 60 ml restants de solution diluée contenant 3,33 mg/ml doivent être administrés par perfusion IV en 60 minutes.
La perfusion doit être administrée à l’aide d’un dispositif de perfusion contrôlée, de la tubulure de perfusion fournie par le fabricant et d’une ligne IV dédiée. L’itraconazole ne doit pas être mélangé à d’autres médicaments et ne doit pas être administré par la même ligne IV que d’autres médicaments. Une fois la perfusion terminée, le fabricant recommande de rincer le dispositif de perfusion via le robinet à deux voies en injectant 15 à 20 ml de chlorure de sodium à 0,9 % en l’espace de 30 secondes à 15 minutes ; l’ensemble de la ligne IV doit ensuite être jeté. Une solution de chlorure de sodium bactériostatique ne doit pas être utilisée comme solution de rinçage car la compatibilité de la solution d’itraconazole avec des solutions de rinçage autres que le chlorure de sodium à 0,9 % n’est pas connue.
Dosage
En raison des différences de biodisponibilité orale, les gélules et la solution orale d’itraconazole ne doivent pas être utilisées de manière interchangeable sur une base mg pour mg.
La posologie des gélules d’itraconazole doit être basée sur le type et la gravité de l’infection, l’identité de l’organisme responsable et la réponse du patient au traitement. Le médicament semble subir un métabolisme saturable dans le foie ; par conséquent, les augmentations de la posologie peuvent entraîner des augmentations plus que proportionnelles des concentrations plasmatiques.
Pour le traitement des infections fongiques systémiques menaçant le pronostic vital, l’administration d’itraconazole par voie IV ou de gélules d’itraconazole par voie orale doit être initiée à l’aide d’une dose de charge. Si l’itraconazole IV est utilisé initialement, la dose de charge recommandée chez les adultes est de 200 mg IV deux fois par jour pendant 4 doses consécutives, suivie de 200 mg une fois par jour par la suite.
Bien que les études cliniques évaluant la sécurité et l’efficacité des gélules orales d’itraconazole n’aient pas inclus de dose de charge, sur la base de considérations pharmacocinétiques, le fabricant et certains cliniciens affirment que les gélules orales d’itraconazole doivent être initiées dans les infections menaçant le pronostic vital chez les adultes en utilisant une dose de charge initiale de 200 mg trois fois par jour (600 mg par jour) pendant les trois ou quatre premiers jours du traitement. Le traitement ultérieur peut ensuite être poursuivi à la dose orale habituelle de 200-400 mg par jour.
Le fabricant indique que le traitement par itraconazole doit être poursuivi pendant au moins trois mois, jusqu’à ce que les paramètres cliniques et les tests de laboratoire indiquent que l’infection fongique active a disparu. Selon certains cliniciens, bien que la durée optimale du traitement des infections fongiques graves n’ait pas été établie, le traitement à l’itraconazole devrait probablement être poursuivi pendant au moins 12 mois pour l’histoplasmose pulmonaire disséminée ou chronique et pendant 6 à 12 mois pour la blastomycose. Une période de traitement inadéquate peut entraîner une récurrence de l’infection active.
| Condition | Dosage | Voie d’administration | Durée du traitement |
|---|---|---|---|
| Aspergillose pulmonaire/extrapulmonaire | 200-400 mg par jour ; des doses plus élevées (jusqu’à 600 mg) peuvent être utilisées pour les cas invasifs | Voie orale/IV | IV : 200 mg deux fois par jour pendant 4 doses, puis 200 mg une fois par jour ; Oral : selon les besoins |
| Blastomycose/Histoplasmose | Initiale : 200 mg une fois par jour ; augmenter par paliers de 100 mg jusqu’à un maximum de 400 mg par jour | Orale/IV | Au moins 6 mois pour la blastomycose ; 12-24 mois pour l’histoplasmose chronique |
| Candidose oropharyngée | 100 mg/jour pour les patients non compromis ; 200-400 mg/jour pour les patients neutropéniques | Solution orale | Minimum de 3 semaines |
| Candidose œsophagienne | 100 mg (10 ml) par jour, peut être augmenté à 200 mg (20 ml) par jour en fonction de la réponse | Solution orale | Minimum de 3 semaines |
| Candidose vaginale | Deux doses de 200 mg à 6-8 heures d’intervalle | Solution orale | Traitement d’un jour |
| Sporotrichose | 100-200 mg une fois par jour pour les infections cutanées ; 200 mg deux fois par jour pour les infections ostéo-articulaires | Traitement par voie orale | 3-6 mois pour les infections cutanées ; 12 mois pour les infections ostéo-articulaires |
| Onychomycose | 200 mg une fois par jour pour les ongles des orteils (12 semaines) ; dose pulsée de 400 mg une fois par jour pendant une semaine chaque mois pendant 3 mois | Voie orale | Varie selon le régime |
| Traitement empirique chez les patients neutropéniques fébriles | IV : 200 mg deux fois par jour pendant 4 doses, puis diminution à 200 mg une fois par jour ; oral : 200 mg (20 ml) deux fois par jour jusqu’à guérison | IV/Oral | Jusqu’à 14 jours par voie IV, puis par voie orale jusqu’à la guérison |
| Dermatophytoses cutanées | 100 mg/jour | Voie orale | Tinea corporis/cruris : 2 semaines ; Tinea pedis/manuum : 4 semaines |
| Pityriasis versicolor | 200 mg/jour | Voie orale | 1 semaine |
| Infection fongique sous-cutanée/profonde | 200-400 mg/jour ; des doses de charge allant jusqu’à 600 mg/jour peuvent être utilisées en cas d’infections mettant en jeu le pronostic vital | Voie orale | En continu, selon les besoins |
| Traitement d’entretien à long terme chez les patients atteints du SIDA | Histoplasmose/Cryptococcose : 200 mg/jour ; patients neutropéniques : 400 mg/jour | Par voie orale |
Généralement poursuivi à vie
|
Prévention des infections fongiques chez les personnes infectées par le VIH
| Condition | Dosage | Voie d’administration | Durée du traitement |
|---|---|---|---|
| Prophylaxie primaire contre la cryptococcose | Adultes/adolescents : 200 mg une fois par jour ; nourrissons/enfants : 2-5 mg/kg toutes les 12-24 heures | Voie orale | En continu selon les besoins |
| Prophylaxie primaire contre l’histoplasmose | Adultes/adolescents : 200 mg une fois par jour ; nourrissons/enfants : 2-5 mg/kg toutes les 12-24 heures | Voie orale | En permanence, si nécessaire |
| Prophylaxie secondaire de la coccidioïdomycose | Adultes/adolescents : 200 mg deux fois par jour ; nourrissons/enfants : 2-5 mg/kg toutes les 12-48 heures | Par voie orale | Généralement poursuivi à vie |
| Prophylaxie secondaire de l’histoplasmose | Adultes/adolescents : 200 mg deux fois par jour ; nourrissons/enfants : 2-5 mg/kg toutes les 12-48 heures | Voie orale | Généralement poursuivie à vie |
| Prophylaxie secondaire de la cryptococcose | Adultes/adolescents : 200 mg une fois par jour ; nourrissons/enfants : 2-5 mg/kg toutes les 12-24 heures | Voie orale | Généralement poursuivie à vie |
| Prophylaxie secondaire de la candidose mucocutanée | Adultes/adolescents : 200 mg une fois par jour ; nourrissons/enfants : 5 mg/kg une fois par jour | Solution orale | Généralement poursuivi à vie |
Posologie en cas d’insuffisance rénale et hépatique
Il ne semble pas nécessaire d’ajuster la posologie de l’itraconazole oral chez les patients souffrant d’insuffisance rénale. L’itraconazole injectable ne doit pas être administré aux patients présentant une insuffisance rénale (c’est-à-dire une clairance de la créatinine inférieure à 30 ml/minute) car une insuffisance rénale sévère réduit la clairance de l’hydroxypropyl-b-cyclodextrine (un excipient de l’itraconazole injectable).
Bien que l’effet de l’insuffisance hépatique sur la pharmacocinétique de l’itraconazole reste à élucider, le fabricant indique que les concentrations plasmatiques du médicament doivent être surveillées attentivement chez les patients souffrant d’une telle insuffisance.
Au Royaume-Uni, l’itraconazole liquide oral est autorisé pour le traitement des candidoses orales et œsophagiennes à raison de 200 mg par jour pendant une semaine. Il peut être pris en une seule dose quotidienne ou, de préférence, en deux doses fractionnées, le liquide étant conservé dans la bouche pendant 20 secondes avant d’être avalé. En l’absence de réponse au bout d’une semaine, le traitement peut être poursuivi pendant une semaine supplémentaire.
Aux États-Unis, un régime similaire est autorisé pour la candidose oropharyngée, mais pour la candidose œsophagienne, un régime alternatif de 100 mg par jour pendant au moins trois semaines est préférable, bien que la dose puisse être augmentée à 200 mg par jour si nécessaire.
Certaines autorités américaines, telles que les Centers for Disease Control and Prevention, recommandent une dose plus élevée. L’itraconazole peut également être administré par perfusion intraveineuse à raison de 200 mg deux fois par jour pendant une heure pendant deux jours, puis 200 mg par jour par la suite.
Doses élevées
Des doses de 600 mg d’itraconazole par jour en deux prises pendant 3 à 16 mois ont été utilisées chez 8 patients atteints de mycoses systémiques résistantes au traitement conventionnel. Deux patients atteints du SIDA et d’une méningite cryptococcique n’ont pas répondu au traitement, et deux patients qui ont répondu au traitement dans un premier temps ont rechuté ou ont développé une maladie progressive lorsque la dose a été réduite. Les principaux effets indésirables ont été l’hypokaliémie, l’hypertension et l’œdème, probablement associés à la suppression des surrénales. Chez un patient atteint d’aspergillose cérébrale, l’administration de 800 mg d’itraconazole par jour pendant 5 mois, puis de 400 mg par jour pendant 4 mois, a entraîné une résolution complète des lésions cérébrales.
Administration chez l’enfant
| Indication | Groupe d’âge | Dosage | Durée du traitement |
|---|---|---|---|
| Tinea Capitis | Enfants < 20 kg | 50 mg par jour par voie orale | Selon la prescription |
| Enfants ≥ 20 kg | 100 mg par jour par voie orale | Selon la prescription | |
| Candidose oropharyngée | 1 mois à 12 ans | 3 à 5 mg/kg (max 100 mg) par jour | 15 jours |
| 12 à 18 ans | 100 mg (200 mg en cas de neutropénie ou de SIDA) par jour | 15 jours | |
| Infections à dermatophytes | 1 mois à 12 ans | 3 à 5 mg/kg par jour (max. 200 mg pour le pityriasis versicolor, max. 100 mg pour les tinea corporis, cruris, pedis, manuum) | Variable (7-30 jours, selon le type d’infection) |
| 12 à 18 ans | 200 mg par jour pour le pityriasis versicolor ; 100 mg par jour pour le tinea corporis et cruris ; 100 mg par jour ou 200 mg deux fois par jour pour le tinea pedis et manuum | Variable (7-30 jours, selon le type d’infection) | |
| Onychomycose | 1 à 12 ans | Cures de 5 mg/kg par jour pour les ongles des mains (2 cures) et des pieds (3 cures) | Répétées à 21 jours d’intervalle |
| 12 à 18 ans | Soit 200 mg par jour pendant 3 mois, soit des cures de 200 mg deux fois par jour pour les ongles des mains (2 cures) et des pieds (3 cures) | Répéter à 21 jours d’intervalle | |
| Histoplasmose/infections fongiques systémiques | 1 mois à 18 ans | 5 mg/kg (max. 200 mg) une ou deux fois par jour | Selon la prescription ; deux fois par jour en cas de maladie invasive |
| Prophylaxie en cas de neutropénie | 1 mois à 18 ans | 5 mg/kg (max 200 mg) par jour, augmenté à deux fois par jour si les concentrations plasmatiques d’itraconazole sont faibles | Selon la prescription |
| Prophylaxie en cas d’hémopathie maligne | 1 mois à 18 ans | 2.5 mg/kg deux fois par jour | Commencer avant la transplantation ou la chimiothérapie |
| Doses intraveineuses pour les infections systémiques | 1 mois à 18 ans | 2.5 mg/kg (max. 200 mg) toutes les 12 heures pendant les deux premiers jours, puis une fois par jour pendant 12 jours au maximum | Selon la prescription |
Ces informations peuvent être incomplètes. Consultez les informations sur ce médicament fournies par la Base de données publique des médicaments.
Effets secondaires

Les effets secondaires fréquemment rapportés en France sont les nausées, les maux de tête et les douleurs abdominales. Certains patients peuvent également présenter des éruptions cutanées ou des vertiges. Bien que rares, des problèmes hépatiques peuvent également survenir, nécessitant une surveillance pendant le traitement. En général, ces effets secondaires sont souvent légers et transitoires, mais tout symptôme inhabituel doit être signalé à un professionnel de la santé.
Les effets indésirables les plus fréquents associés à l’itraconazole sont la dyspepsie, les douleurs abdominales, les nausées, les vomissements, la constipation, la diarrhée, les maux de tête et les vertiges. D’autres effets incluent des réactions allergiques telles que prurit, éruption cutanée, urticaire et œdème de Quincke. Des cas isolés de syndrome de Stevens-Johnson ont été associés à l’itraconazole. Une augmentation des valeurs des enzymes hépatiques a été observée chez certains patients, ainsi que des cas d’hépatite et d’ictère cholestatique, en particulier chez les patients traités pendant plus d’un mois.
De rares cas d’insuffisance hépatique et de décès ont été observés. Des cas d’insuffisance cardiaque et d’œdème pulmonaire ont été rarement rapportés, et des événements cardiovasculaires graves, y compris des arythmies et des morts subites, ont été attribués à des interactions médicamenteuses chez des patients recevant de l’itraconazole (voir Interactions ci-dessous). L’alopécie, l’œdème et l’hypokaliémie ont également été associés à une utilisation prolongée.
Des troubles menstruels et une neuropathie périphérique ont été rapportés chez quelques patients.
Incidence des effets indésirables
L’itraconazole, administré à raison de 50 à 400 mg par jour pendant une durée médiane de 5 mois, a été considéré comme bien toléré chez 189 patients atteints d’infections fongiques systémiques. Sur 86 patients présentant une maladie sous-jacente, dont 49 atteints du SIDA, 16 de diabète et 23 de tumeurs malignes, des nausées et des vomissements ont été observés chez 19 patients, une hypertriglycéridémie chez 16, une hypokaliémie chez 11 et une élévation des valeurs des enzymes hépatiques chez 13. Le rôle de l’itraconazole dans l’hypertriglycéridémie n’a pas pu être évalué car tous les échantillons n’ont pas été prélevés à jeun et l’hypertriglycéridémie est une complication de l’infection par le VIH.
Une gynécomastie est apparue chez deux patients, dont l’un prenait également de la spironolactone.
Des éruptions cutanées ont été observées chez 4 patients. Sur 49 patients prenant de l’itraconazole à raison de 100 à 400 mg par jour pendant 39 mois, 23 n’ont pas ressenti d’effets indésirables pendant le traitement, tandis que 6 ont eu des nausées et des vomissements, 5 ont développé des œdèmes et 2 de l’hypertension. 3 des patients qui ont développé des œdèmes et 1 qui est devenu hypertendu étaient diabétiques. Trois patients ont arrêté l’itraconazole, 1 en raison de vomissements, 1 en raison d’une leucopénie et 1 en raison d’un syndrome néphrotique. Le patient atteint du syndrome néphrotique présentait un œdème et une hypertension préexistants. Le syndrome a disparu à l’arrêt de l’itraconazole.
Troubles cardiovasculaires
La fibrillation ventriculaire a été attribuée à l’hypokaliémie induite par l’itraconazole.
Un épanchement pleural puis péricardique s’est développé chez une femme traitée par 200 mg d’itraconazole par jour pour une infection pulmonaire localisée à Aspergillus fumigatus. Après plus de 9 semaines de traitement, elle a développé un épanchement péricardique qui a nécessité un drainage. L’itraconazole a été retiré. Six semaines plus tard, et 2 semaines après la reprise de l’itraconazole, elle a développé des signes d’œdème pulmonaire et d’hypertrophie cardiaque. Ces signes ont disparu rapidement à l’arrêt de l’itraconazole.
Des études menées chez des chiens et des volontaires humains sains ont suggéré que l’itraconazole a un effet inotrope négatif ; le mécanisme est inconnu. Une analyse systématique des données du système de notification des événements indésirables (AERS) de la FDA a identifié 58 cas suggérant une insuffisance cardiaque congestive chez des patients prenant de l’itraconazole. Une recherche simultanée n’a pas permis d’identifier de cas d’insuffisance cardiaque congestive chez des patients prenant du fluconazole et du kétoconazole, ce qui exclut la possibilité d’un effet de classe. En conséquence, l’étiquetage de l’itraconazole a été révisé. L’itraconazole est désormais contre-indiqué pour le traitement de l’onychomycose chez les patients présentant des signes de dysfonctionnement ventriculaire.
Pour les infections fongiques systémiques, les risques et les bénéfices de l’itraconazole doivent être réévalués en cas d’apparition de signes ou de symptômes d’insuffisance cardiaque congestive.
Système nerveux
Des céphalées dues à l’itraconazole ont été mentionnées dans certains rapports. Les vertiges sont peu fréquents, de même que les troubles de l’humeur.
Psychologie, psychiatrie
Des hallucinations visuelles accompagnées de confusion ont été signalées chez une femme de 75 ans, à trois reprises, chaque fois environ 2 heures après une dose de 200 mg d’itraconazole. Ses symptômes ont disparu spontanément en l’espace d’environ 8 heures.
Équilibre électrolytique
Une hypokaliémie, isolée ou associée à une hypertension, a été signalée régulièrement chez un petit nombre de patients. Un œdème marqué de la cheville avec prise de poids a été observé chez un patient prenant 400 mg/jour d’itraconazole, pour lequel il n’y avait pas d’autre explication que l’utilisation du médicament ; après l’arrêt de l’itraconazole, les symptômes ont disparu. Une hypokaliémie et un œdème ont également été observés chez un certain nombre de patients recevant un traitement à forte dose (600 mg/jour), associés à des concentrations d’aldostérone légèrement déprimées.
Appareil digestif
Des dyspepsies, des pyrosis, des nausées, des vomissements, une légère gêne épigastrique et des diarrhées peuvent survenir chez les patients prenant de l’itraconazole. Ces troubles gastro-intestinaux sont généralement bénins, mais ils semblent être les effets indésirables les plus fréquents pendant le traitement. L’incidence totale des effets indésirables était de 3 à 5 % chez les patients traités pour une mycose superficielle et de 8 % chez 99 patients traités pour une mycose profonde. Un essai multicentrique a rapporté une incidence plus proche de 15 %.
Chez 50 femmes atteintes de candidose vaginale aiguë, des effets indésirables ont été signalés chez 17 d’entre elles (35 %), des nausées chez sept, des céphalées chez six, des vertiges chez trois et des ballonnements chez trois, tandis que l’activité de la transaminase aspartate a été augmentée chez une.
Sur 1108 patients séropositifs traités pour une candidose des muqueuses, 239 ont signalé des symptômes gastro-intestinaux.
Une colite pseudomembraneuse a été rapportée en association avec une exposition à l’itraconazole.
Un homme de 54 ans a développé de nouvelles douleurs abdominales et une diarrhée non sanglante un mois après avoir été exposé à une cure de 7 jours d’itraconazole oral à raison de 200 mg/jour. Il prenait de la sertraline, de l’acide valproïque et de la perphénazine de façon chronique et stable et n’avait pas pris de médicaments antimicrobiens depuis 6 mois. La sigmoïdoscopie flexible pratiquée après l’évolution clinique a révélé des pseudomembranes, et l’évaluation ultérieure a exclu d’autres causes de diarrhée. Bien que la culture de Clostridium difficile et le dosage des toxines se soient finalement révélés négatifs, peut-être en raison d’un retard dans l’échantillonnage des selles, le patient a répondu à un traitement médicamenteux anti-anaérobie de 10 jours et a été autorisé à sortir de l’hôpital avec des symptômes complètement résolus.
Les auteurs ont proposé que l’itraconazole ait perturbé la flore fongique résidente du côlon.
Foie
Dans la plupart des rapports cliniques, il y a eu quelques cas d’augmentation des activités des enzymes hépatiques ; les changements ont été transitoires ou ont disparu après l’arrêt de l’itraconazole. Aucune hépatotoxicité plus grave n’a été signalée.
Une hyperplasie nodulaire focale du foie a été rapportée chez une femme de 38 ans qui avait pris 200 mg/jour d’itraconazole pendant 4 mois pour une infection fongique des ongles. Elle n’avait pris aucun autre médicament pendant l’année au cours de laquelle l’hyperplasie nodulaire focale s’est développée.
Sur les trois patients, deux femmes âgées de 62 et 57 ans et un homme âgé de 75 ans, qui ont développé une atteinte hépatique symptomatique 5-6 semaines après avoir commencé à prendre de l’itraconazole, deux présentaient le profil biochimique d’une atteinte hépatique cholestatique.
Tous les essais cliniques sur l’itraconazole parrainés par la Janssen Research Foundation pour le traitement de l’onychomycose, dans lesquels il y a eu une évaluation de la sécurité en laboratoire, ont été analysés. Il n’y a pas eu de différences significatives dans le nombre d’anomalies de code 4 (la valeur de base est dans l’intervalle de référence et au moins deux valeurs, ou le dernier test dans la période d’observation, dépassent deux fois la limite supérieure de l’intervalle de référence) dans les tests de la fonction hépatique (alanine transaminase, aspartate transaminase, phosphatase alcaline et bilirubine totale). L’incidence de toutes les anomalies de code 4 était inférieure à 2 %. La thérapie pulsée à l’itraconazole pour l’onychomycose semble sûre, en particulier du point de vue des lésions hépatiques potentielles. Dans la notice de l’itraconazole, des tests de la fonction hépatique sont recommandés chez les patients recevant de l’itraconazole en continu pendant plus d’un mois. Il n’y a pas d’exigence de surveillance pour le régime pulsé, sauf si le patient a des antécédents de maladie hépatique sous-jacente, si les tests de la fonction hépatique sont anormaux au départ ou si des signes ou des symptômes suggérant un dysfonctionnement hépatique apparaissent à un moment ou à un autre.

Peau
Des patients prenant de l’itraconazole ont signalé différents types d’éruptions cutanées, y compris des éruptions acnéiformes. Dans un cas, il y avait des bulles sanguinolentes.
Un homme de 29 ans a développé une éruption maculopapulaire infiltrante après une semaine d’itraconazole 100 mg bd pour une tinea corporis. L’itraconazole a été retiré et les lésions ont disparu en 7 jours. Les tests de grattage, les tests épicutanés, les tests de grattage et les tests de stimulation des lymphocytes induits par le médicament pour l’itraconazole se sont révélés négatifs ; cependant, une nouvelle provocation avec de l’itraconazole systémique a induit une éruption maculopapulaire sur le visage, les mains et la face dorsale des pieds. Les gélules d’itraconazole vides n’ont pas eu d’effets cutanés, ce qui suggère une réaction allergique à un métabolite du composé.
La photosensibilité a été attribuée à l’itraconazole (200 mg qds pendant 5 jours), avec une dose d’érythème minimale réduite pour les UVB (0,12 J/cm) et les UVA (20,1 J/cm), un test de patch photo négatif et un défi photo positif. Les auteurs ont proposé un mécanisme photoallergique parce que l’exposition antérieure à l’itraconazole s’était déroulée sans incident. Cependant, ils n’ont pas donné de détails sur l’exposition au soleil lors de la première exposition et sur l’intensité de l’exposition au soleil lors de la procédure de photo-diagnostic par voie orale. L’éruption a répondu aux stéroïdes oraux, ce qui est plus typique des réactions photoallergiques que des réactions phototoxiques.
Le risque de troubles cutanés graves a été estimé chez 61 858 utilisateurs de médicaments antifongiques oraux, âgés de 20 à 79 ans, identifiés dans la base de données britannique de recherche sur les pratiques générales. Ils avaient reçu au moins une prescription de fluconazole, de griséofulvine, d’itraconazole, de kétoconazole ou de terbinafine par voie orale. Le taux de base d’effets indésirables cutanés graves (correspondant à la non-utilisation d’antifongiques oraux) était de 3,9 pour 10 000 personnes-années (IC à 95 % = 2,9). Les taux d’incidence pour l’utilisation actuelle étaient de 15 pour 10 000 personnes-années (1 pour l’itraconazole, 11,1 (3 pour la terbinafine, 10 (1 pour le fluconazole et 4,6 (0 pour la griséofulvine). Les troubles cutanés associés à l’utilisation d’antifongiques oraux dans cette étude étaient tous bénins.
Fonction sexuelle
Les rapports concernant les effets de l’itraconazole sur les stéroïdes sexuels sont contradictoires. Les concentrations de testostérone, de corticostérone et de progestérone sont restées inchangées chez les rats et les six chiens chez qui les effets endocriniens possibles ont été étudiés. D’autre part, l’administration d’itraconazole à sept volontaires masculins pendant deux semaines n’a pas entraîné de modifications détectables des concentrations plasmatiques de testostérone ou de cortisol. Deux semaines après le début d’un traitement par itraconazole à forte dose (600 mg/jour), l’un des huit patients atteints de mycose grave a présenté une réponse légèrement réduite du cortisol à la stimulation par l’ACTH.
Des cas d’impuissance érectile, avec des concentrations normales de stéroïdes, ont été rapportés, ainsi qu’une réduction de la libido.
Immunologique
L’itraconazole, à raison de 200 mg par jour pendant 2 semaines, a provoqué une réaction de type maladie sérique chez une femme de 53 ans atteinte de la maladie de Ménière.
La plupart des effets indésirables rapportés de l’itraconazole sont transitoires. Les réactions gastro-intestinales, les dyspepsies légères, le pyrosis, les nausées, les vomissements, les diarrhées et les douleurs épigastriques ne sont pas rares. De nombreux rapports publiés font état d’augmentations des activités enzymatiques hépatiques sériques et d’hypertriglycéridémie, et des cas de toxicité hépatique symptomatique ont été rapportés. L’itraconazole n’induit pas d’enzymes métabolisant les médicaments et est un inhibiteur plus faible des enzymes microsomales que le kétoconazole. Chez les rats ayant reçu des doses allant jusqu’à 160 mg/kg, il n’y a pas eu d’induction ou d’inhibition du métabolisme des xénobiotiques.
Une hypokaliémie a souvent été rapportée sans que l’on puisse en expliquer le mécanisme. Des doses plus élevées (400 ou même 600 mg/jour) entraînent une augmentation de l’incidence des effets indésirables ; parmi ceux documentés à ces doses figurent une hypokaliémie sévère, une insuffisance surrénale réversible et (dans un cas publié) des arythmies, ces dernières étant liées à une interaction avec la terfénadine. Des éruptions cutanées et un prurit ont été signalés. Aucun effet tumoral n’a été décrit.
Les effets indésirables les plus fréquents chez les patients prenant des gélules d’itraconazole pendant des périodes prolongées étaient des nausées et des vomissements (moins de 10 %), une hypertriglycéridémie (9 %), une hypokaliémie (6 %), une élévation des transaminases (5 %), des éruptions cutanées et/ou un prurit (2 %), des céphalées ou des vertiges (moins de 2 %) et un œdème du pied (1 %).
Dans une étude utilisant la base de données britannique de recherche en médecine générale pour déterminer les taux d’effets indésirables rares et graves sur le foie, les reins, la peau ou le sang, survenus dans les 45 jours suivant la réalisation d’une prescription ou d’un renouvellement chez 54 803 utilisateurs de fluconazole ou d’itraconazole, un patient a présenté un test de fonction hépatique anormal pendant qu’il prenait de l’itraconazole et une étiologie médicamenteuse n’a pas pu être exclue, soit un taux de 3,2 pour 100 000 prescriptions (IC à 95 % pour les effets indésirables graves sur le foie). Ainsi, l’itraconazole n’a généralement pas d’effets indésirables graves sur le foie, les reins, la peau ou le sang.
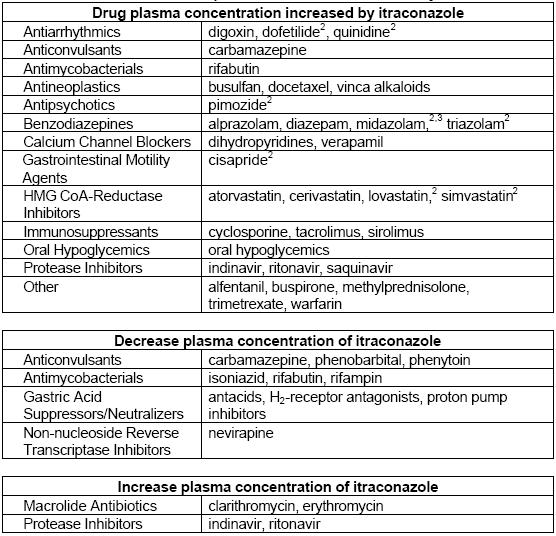
Interactions
| Catégorie | Médicament | Interaction avec l’itraconazole | Effets |
|---|---|---|---|
| Statines | Atorvastatine | Augmentation des concentrations sériques due à l’inhibition du CYP3A4. | AUC augmentée de 150%, Cmax augmentée de 38%, demi-vie prolongée de 30%. |
| Cérivastatine | Augmentation modeste des concentrations sériques ; la voie secondaire du CYP2C8 n’est pas affectée par l’itraconazole. | Légères augmentations de l’ASC, de la Cmax et de la demi-vie (jusqu’à 51 %, 25 % et 23 % respectivement). | |
| Fluvastatine | Pas d’effet significatif sur la Cmax ou l’AUC ; légère prolongation de la demi-vie. | Interaction minimale ; considérée comme sûre avec l’itraconazole. | |
| Lovastatine | Augmentation importante des concentrations plasmatiques, même à de faibles doses d’itraconazole. | Cmax multipliée par ~15, ASC totale multipliée par >15 ; prudence conseillée. | |
| Pravastatine | Légères augmentations de l’ASC et de la Cmax ; changements non statistiquement significatifs. | La demi-vie reste inchangée ; interaction minimale observée. | |
| Simvastatine | Augmentation marquée de l’exposition systémique en cas d’association avec l’itraconazole. | Cmax et AUC multipliées au moins par 10 ; risque significatif de rhabdomyolyse observé dans certains cas. | |
| Glucocorticoïdes | Budésonide | Inhibition accrue de la clairance métabolique entraînant une insuffisance surrénalienne chez certains patients. | ASC multipliée par 4,2, demi-vie prolongée de 1,6 à 6,2 heures ; suppression significative du cortisol observée. |
| Dexaméthasone | Augmentation marquée de l’exposition et des effets systémiques en raison de la réduction de la clairance par l’itraconazole. | L’ASC a été multipliée par près de quatre, la demi-vie a été prolongée de plus de trois fois ; des taux de cortisol plus faibles ont été observés. | |
| Méthylprednisolone | Augmentation significative de l’exposition due à l’inhibition du CYP3A4 par l’itraconazole. | ASC multipliée par 3,9, demi-vie prolongée de 2,1 à 4,8 heures ; augmentation de la suppression surrénalienne observée. | |
| Prednisolone | Interaction mineure avec une signification clinique limitée par rapport à la méthylprednisolone. | ASC augmentée de 24%, demi-vie prolongée de 29% ; utilisation généralement sûre avec l’itraconazole. |
Autres interactions
Tacrolimus
Les concentrations et la toxicité du tacrolimus sont affectées par l’itraconazole.
- Chez un homme de 17 ans atteint de fibrose kystique et ayant reçu une transplantation hépato-pulmonaire, on a observé une interaction entre l’itraconazole 600 mg par jour et le tacrolimus. Des concentrations minimales élevées de tacrolimus ont été observées, malgré la posologie relativement faible (0,1-0,3 mg/kg/jour).
- Un autre patient a présenté une interaction entre le tacrolimus 0,085 mg /kg bd et l’itraconazole 200-400 mg par jour, entraînant une acidocétose, une neutropénie et une thrombocytopénie, ce qui a nécessité l’arrêt des deux médicaments.
- Un homme de 30 ans ayant subi une transplantation rénale a vu ses concentrations sanguines de tacrolimus multipliées par plus de deux après avoir commencé à prendre 200 mg/jour d’itraconazole, ce qui s’est accompagné d’une réduction du taux de filtration glomérulaire et d’une tubulopathie associée au tacrolimus prouvée par biopsie.
Le tacrolimus ayant un index thérapeutique étroit, les concentrations sanguines doivent être surveillées avec une attention particulière en cas d’administration concomitante d’itraconazole, et la posologie du tacrolimus peut devoir être modifiée.
L’interaction entre l’itraconazole (100 mg bd) et le tacrolimus a été étudiée chez 28 transplantés cardiaques ou pulmonaires. Les concentrations sanguines de tacrolimus ont été contrôlées un jour sur deux jusqu’à 21 jours après le début du traitement par l’itraconazole ou son arrêt. La dose de tacrolimus a été ajustée pour maintenir la concentration sanguine minimale sur 12 heures entre 7 et 12 microgrammes/ml.
La dose moyenne de tacrolimus pendant le traitement par l’itraconazole a diminué de façon significative, passant de 8,4 à 2,9 mg/jour. Il n’y a pas eu de changement significatif de la créatinine sérique ou des tests de la fonction hépatique. Chez les patients chez qui l’itraconazole a été retiré, la dose moyenne de tacrolimus nécessaire a augmenté de manière significative, passant de 4,7 à 8,8 mg/jour. Ainsi, des modifications substantielles de la dose de tacrolimus ont été nécessaires à la fois lors de l’instauration et de l’arrêt de l’itraconazole, et il a été difficile de maintenir les concentrations sanguines de tacrolimus dans la fourchette cible au cours des 2 premières semaines. Cependant, il n’y a pas eu de toxicité majeure ou de rejet.
L’administration concomitante d’itraconazole peut réduire le coût de l’immunosuppression post-transplantation. Cette interaction est probablement due à l’inhibition du CYP3A4 par l’itraconazole.
Alcaloïdes de Vinca
L’augmentation de la neurotoxicité des vinca-alcaloïdes, qui peut menacer le pronostic vital, en cas de traitement concomitant avec l’itraconazole, a fait l’objet de plusieurs rapports convaincants. Le renforcement de la neurotoxicité de la vincristine se traduit par une polyneuropathie et un iléus paralytique. L’interaction est réversible et la lecture-traction des alcaloïdes de la pervenche peut être sûre après un lavage prolongé. Le mécanisme n’a pas été formellement élucidé, mais il pourrait s’agir soit d’une compétition pour le métabolisme oxydatif, entraînant une augmentation de l’exposition systémique, soit d’une inhibition de la pompe d’efflux de la glycoprotéine P transmembranaire, entraînant une augmentation des concentrations intracellulaires des alcaloïdes de la pervenche. L’utilisation concomitante d’itraconazole et d’alcaloïdes de la pervenche est donc contre-indiquée.
Deux adultes atteints de leucémie lymphoblastique aiguë ont développé une neurotoxicité inhabituellement sévère causée par la vincristine, qui était probablement le résultat d’une interaction avec la suspension d’itraconazole.
Warfarine
L’itraconazole peut modifier les concentrations de warfarine.
Suite à l’ajout d’itraconazole à un traitement comprenant de la warfarine, de la ranitidine et de la terfénadine, des dysrythmies cardiaques sont apparues chez un homme de 62 ans. Les signes et symptômes comprenaient un allongement de l’intervalle QT et une fibrillation ventriculaire.
Ce traitement particulier a apparemment donné lieu à une deuxième interaction, puisque des concentrations élevées inattendues de terfénadine ont été observées. D’autres ont décrit ce phénomène, qui implique une augmentation marquée des concentrations sériques de terfénadine et une toxicité accrue du médicament lors de l’ingestion simultanée d’itraconazole. Le mécanisme n’est pas connu, mais il est probablement lié à l’inhibition du CYP3A4.
Zolpidem
Le zolpidem est principalement transformé par le CYP3A4. Cependant, l’itraconazole 200 mg n’a pas modifié la pharmacocinétique et la pharmacodynamique du zolpidem 10 mg chez 10 volontaires sains. Par conséquent, le zolpidem peut être utilisé à des doses normales ou presque normales en association avec l’itraconazole.
Amphotéricine
Six souches d’A. fumigates ont été utilisées pour tester les effets in vitro de l’association d’amphotéricine et d’itraconazole. Après prétraitement, un effet antagoniste a été constaté pour toutes les souches in vitro et pour une souche dans un modèle murin d’aspergillose.
L’effet de l’association de l’itraconazole et de l’amphotéricine sur les activités enzymatiques hépatiques a été étudié rétrospectivement chez 20 patients atteints de tumeurs malignes hématologiques ou de maladies pulmonaires chroniques compliquées par une infection ou une colonisation fongique. Ils ont pris de l’itraconazole à raison de 200 à 600 mg/jour pendant une durée médiane de 143 jours (intervalle de 44 jours). Neuf d’entre eux ne présentaient aucune anomalie des tests de la fonction hépatique, y compris des périodes de fortes concentrations d’itraconazole (plus de 5000 µg/ml) et de son métabolite actif hydroxylé ; un seul avait reçu de l’amphotéricine en concomitance. Les 11 patients présentant des anomalies de la fonction hépatique avaient tous reçu de l’amphotéricine en concomitance.
Pour chaque patient, les anomalies de la fonction hépatique étaient les plus importantes lors d’un traitement concomitant avec les deux médicaments antifongiques. Bien que les anomalies des enzymes hépatiques soient rares avec l’amphotéricine, et bien que cette analyse rétrospective ait été sujette à plusieurs défauts et biais potentiels, elle suggère néanmoins que l’hépatotoxicité doit être surveillée de près si l’itraconazole et l’amphotéricine sont administrés de façon concomitante.
Antihistaminiques
Il semble probable que l’association de l’itraconazole avec l’astémizole et la terfénadine entraîne une augmentation des effets de ces antihistaminiques.
Barbituriques
Les barbituriques diminuent les concentrations d’itraconazole.
Benzodiazépines
L’effet de l’itraconazole sur la pharmacocinétique et la pharmacodynamique d’une dose orale unique d’estazolam a été étudié dans le cadre d’une étude en double aveugle, randomisée et croisée chez 10 volontaires sains de sexe masculin, qui ont pris par voie orale 100 mg/jour d’itraconazole ou un placebo pendant 7 jours et, le quatrième jour, une dose orale unique de 4 mg d’estazolam. Des prélèvements sanguins et une évaluation de la fonction psychomotrice par le test de substitution des symboles numériques, l’échelle visuelle analogique et l’échelle de somnolence de Stanford ont été effectués jusqu’à 72 heures après l’administration d’estazolam. Il n’y a pas eu de différence significative entre les phases placebo et itraconazole en ce qui concerne le pic de concentration plasmatique, la clairance et la demi-vie. De même, la fonction psycho-motrice n’a pas été affectée. Ces résultats suggèrent que le CYP3A4 ne joue pas un rôle majeur dans le métabolisme de l’estazolam.
Dans une étude des effets de l’itraconazole 200 mg/jour et de la rifampicine 600 mg/jour sur la pharmacocinétique et la pharmacodynamique du midazolam oral 7,5-15 mg pendant et 4 jours après la fin du traitement, le passage de l’inhibition à l’induction du métabolisme a entraîné une modification de l’ASC du midazolam oral pouvant aller jusqu’à 400 fois.
Bupivacaïne
L’interaction entre l’itraconazole 200 mg par voie orale pendant 4 jours et une dose intraveineuse unique de bupivacaïne racémique (0,3 mg /kg administré en 60 minutes) a été examinée dans une étude croisée contrôlée par placebo chez 10 volontaires sains. L’itraconazole a réduit la clairance de la R-bupivacaïne de 21 % et celle de la 5-bupivacaïne de 25 %, mais n’a pas eu d’autres effets significatifs sur la pharmacocinétique des énantiomères. La réduction de la clairance de la bupivacaïne par l’itraconazole est susceptible d’augmenter les concentrations à l’état d’équilibre des énantiomères de la bupivacaïne de 20 à 25 %, ce qui doit être pris en compte lors de l’utilisation concomitante de l’itraconazole et de la bupivacaïne.
Buspirone
L’interaction de l’itraconazole avec le métabolite actif l-(2-pyrimidinyl)-pipérazine de la buspirone a été étudiée après une dose orale unique de 10 mg de buspirone. L’itraconazole a réduit l’ASC moyenne du métabolite de 50 % et la Cmax de 57 %, alors que l’ASC moyenne et la Cmax de la molécule mère ont été multipliées par 14,5 et 10,5, respectivement. Ainsi, l’itraconazole a entraîné des modifications relativement mineures des concentrations plasmatiques du métabolite piperazine actif de la buspirone, bien qu’il ait eu des effets importants sur les concentrations de buspirone après l’administration d’une dose orale unique.
Busulfan
Une réduction de l’élimination et une augmentation de la toxicité du busulfan administré conjointement avec l’itraconazole ont été signalées.
Carbamazépine
Des concentrations sériques faibles et parfois très faibles d’itraconazole ont été observées lors d’un traitement concomitant d’itraconazole et de carbamazépine.
Ciclosporine
L’association de l’itraconazole et de la ciclosporine entraîne une augmentation marquée des concentrations sanguines de ciclosporine, ce qui peut augmenter la créatinine sérique. Cela indique clairement une atteinte rénale causée par les concentrations élevées de ciclosporine. Cependant, une interaction n’a pas été démontrée dans tous les cas.
Deux cas de rhabdomyolyse provoquée par l’itraconazole chez des transplantés cardiaques prenant à long terme de la ciclosporine et de la simvastatine ont été rapportés. Pour éviter une myopathie grave, les concentrations de ciclosporine doivent être contrôlées fréquemment et les statines doivent être retirées ou la posologie doit être réduite tant que des azoles doivent être prescrits à des receveurs de greffe. Les patients doivent être informés des signes et symptômes qui nécessitent l’intervention immédiate d’un médecin.
Tampon citrate-phosphate
Le tampon citrate-phosphate utilisé pour faciliter l’absorption de la didésoxyinosine (didanosine), prescrite pour le traitement du SIDA, peut interférer avec l’absorption de l’itraconazole.
Clarithromycine
Un rapport portant sur trois patients séronégatifs a suggéré que le traitement concomitant par l’itraconazole et la clarithromycine peut entraîner une augmentation de l’exposition à la clarithromycine, avec un rapport métabolique accru, peut-être lié à l’effet de l’itraconazole sur le CYP3A4. Néanmoins, cette interaction présumée n’a entraîné d’effets indésirables chez aucune des trois personnes concernées.
Clozapine
L’itraconazole 200 mg n’a pas eu d’effet significatif sur les concentrations sériques de clozapine 200-550 mg/jour ou de desméthylclozapine chez 7 patients schizophrènes.
Digoxine
L’itraconazole inhibe l’élimination de la digoxine, ce qui peut entraîner une toxicité.
L’itraconazole augmente l’AUC0_72 de la digoxine d’environ 50 % et réduit sa clairance rénale d’environ 20 %. Outre l’inhibition de la sécrétion rénale de la digoxine, qui est probablement médiée par l’inhibition de la glycoprotéine P, une étude chez le cobaye a également montré une réduction significative de l’excrétion biliaire de la digoxine par l’itraconazole, ce qui suggère que l’interaction entre l’itraconazole et la digoxine peut être due non seulement à une réduction de la clairance rénale, mais également à une réduction de la clairance métabolique de la digoxine par l’itraconazole.
L’importance de cette interaction a été soulignée par le rapport de deux patients transplantés rénaux qui ont présenté une toxicité à la digoxine après avoir pris de l’itraconazole en même temps.
Famotidine
La famotidine 40 mg/kg/jour a réduit les concentrations maximales et minimales de l’itraconazole 200 mg/kg/jour d’environ 35 % chez 18 patients sous chimiothérapie pour des hémopathies malignes.
Fentanyl
Le fentanyl est un substrat des CYP3A4, CYP2C9 et CYP2C19. Cependant, dans une étude, la pharmacocinétique et la pharmacodynamie du fentanyl 3 microgrammes/kg étaient similaires après l’administration de 200 mg d’itraconazole et d’un placebo chez 10 volontaires sains.
Une interaction entre l’itraconazole et le fentanyl a été rapportée chez un homme de 67 ans atteint d’un cancer et recevant une dose stable de fentanyl transdermique de 50 microgrammes/heure. Il a pris 200 mg d’itraconazole par jour pour une candidose oropharyngée et, 24 heures plus tard, a développé des signes de toxicité opioïde, qui ont été inversés par l’arrêt du fentanyl et le remplacement par des opioïdes à courte durée d’action.
Il peut s’agir d’une interaction à laquelle seules certaines personnes sont sensibles.
Flucytosine
L’association de l’itraconazole et de la flucytosine peut renforcer son activité contre les champignons noirs ; cette association a empêché le développement d’une résistance à la flucytosine.
Informations importantes en matière de sécurité
Le ministère français de la santé a récemment publié des lignes directrices sur l’utilisation des médicaments antifongiques, recommandant une utilisation prudente de l’itraconazole chez les patients souffrant d’une maladie du foie ou prenant des médicaments concomitants susceptibles d’interférer avec le métabolisme du médicament. En outre, les inquiétudes concernant la résistance aux antifongiques ont suscité davantage d’études visant à améliorer les protocoles de traitement des infections fongiques chroniques.
Âge
La sécurité, la tolérance et la pharmacocinétique de l’itraconazole et de son métabolite actif, l’hydroxyitraconazole, après administration d’une solution d’itraconazole dans de l’hydroxy-propyl-P-cyclodextrine ont été étudiées dans le cadre d’une étude multicentrique chez 26 nourrissons et enfants âgés de 6 mois à 12 ans présentant une candidose des muqueuses ou un risque de maladie fongique invasive. On a observé une tendance à des concentrations plasmatiques minimales plus faibles chez les enfants âgés de 6 mois à 2 ans. L’absorption systémique de l’hydro-xypropyl-P-cyclodextrine, le solubilisant, était inférieure à 1 %. Administrée à raison de 5 mg/ kg/jour, cette formulation a permis d’obtenir des concentrations plasmatiques potentiellement thérapeutiques, légèrement inférieures à celles atteintes chez l’adulte, et elle a été bien tolérée et sûre.
L’itraconazole 100 mg/jour a été étudié chez 24 enfants atteints de tinea capitis à Trichophyton tonsurans. L’itraconazole a été bien toléré, mais 15 enfants ont dû être traités à nouveau en raison d’une infection persistante.
La sécurité, la pharmacocinétique et la pharmacodynamie d’une suspension orale de cyclodextrine itraconazole (2,5 mg /kg od ou bd pendant 15 jours) ont été étudiées dans une étude ouverte, séquentielle, à doses croissantes chez 26 enfants et adolescents, âgés de 5 à 18 ans, infectés par le VIH (nombre moyen de CD4 128 x 106/1) et présentant une candidose oropharyngée. Hormis des troubles gastro-intestinaux légers à modérés chez trois patients, l’itraconazole cyclodextrine a été bien toléré.
Deux patients se sont retirés prématurément en raison d’effets indésirables. Le score de candidose oropharyngée a diminué de manière significative, passant d’une moyenne de 7,46 au départ à 2,8 à la fin du traitement, ce qui démontre l’efficacité antifongique dans ce contexte. Sur la base de ces résultats, une posologie de 2,5 mg/ kg bd a été recommandée pour le traitement de la candidose oropharyngée chez les enfants âgés de 5 ans et plus.
La sécurité et l’efficacité de l’itraconazole oral à base de cyclodextrine (5 mg/kg/jour) en tant que prophylaxie antifongique ont été évaluées dans un essai ouvert chez 103 enfants neutropéniques (âge médian de 5 ans ; intervalle de 0 à 15 ans). La prophylaxie a commencé au moins 7 jours avant l’apparition de la neutropénie et s’est poursuivie jusqu’à la récupération des neutrophiles. Sur les 103 patients, seuls 47 ont terminé la prophylaxie ; 27 se sont retirés en raison d’une mauvaise observance, 19 en raison d’événements indésirables et 10 pour d’autres raisons. Des événements indésirables graves (autres que le décès) sont survenus chez 21 patients, notamment des convulsions, des interactions médicamenteuses suspectes, des douleurs abdominales et de la constipation. Les effets indésirables les plus fréquents considérés comme certainement ou probablement liés à l’itraconazole ont été les vomissements, les anomalies de la fonction hépatique et les douleurs abdominales.
La tolérance du médicament de l’étude au point final a été jugée bonne (55 %), modérée (11 %), médiocre (17 %) ou inacceptable (17 %). Il n’y a pas eu de problèmes inattendus concernant la sécurité ou la tolérabilité.
Grossesse, fertilité et allaitement
Bien qu’il n’y ait pas d’études adéquates et contrôlées chez l’homme à ce jour, l’itraconazole s’est révélé tératogène et embryotoxique chez l’animal. Par conséquent, l’itraconazole ne doit être utilisé pendant la grossesse que si les bénéfices potentiels justifient les risques possibles pour le fœtus.
Pour le traitement de l’onychomycose, l’utilisation de l’itraconazole est contre-indiquée chez les femmes enceintes et chez celles qui envisagent une grossesse.
Si un traitement à l’itraconazole pour le traitement de l’onychomycose est instauré chez une femme en âge de procréer, la première dose du médicament doit être administrée le deuxième ou le troisième jour de la prochaine période menstruelle normale, et des mesures doivent être prises pour garantir la poursuite d’une contraception efficace pendant toute la durée du traitement à l’itraconazole et pendant deux mois supplémentaires après l’arrêt du médicament. Dans les études de reproduction, l’itraconazole a entraîné une augmentation liée à la dose de la toxicité maternelle, de l’embryotoxicité et de la tératogénicité chez les rats à des doses d’environ 40-160 mg/kg par jour (5-20 fois la dose maximale recommandée chez l’homme) et chez les souris à des doses d’environ 80 mg/kg par jour (10 fois la dose maximale recommandée chez l’homme).
La tératogénicité s’est traduite par des anomalies squelettiques majeures chez les rats et par des encéphalocèles et/ou une macroglossie chez les souris.
Bien qu’une toxicité parentale ait été observée, les études de reproduction menées chez des rats mâles et femelles recevant par voie orale des doses d’itraconazole allant jusqu’à 40 mg/kg par jour (5 fois la dose maximale recommandée chez l’homme) n’ont pas révélé de signes d’altération de la fertilité. Une toxicité parentale plus sévère, allant jusqu’à la mort, est apparue à une dose de 160 mg/kg par jour (20 fois la dose maximale recommandée chez l’homme).
L’itraconazole est distribué dans le lait maternel, et les bénéfices attendus de l’itraconazole pour la femme qui allaite doivent être mis en balance avec le risque potentiel pour l’enfant d’être exposé au médicament. En raison du risque de transmission du VIH à un enfant non infecté, les Centres américains de contrôle et de prévention des maladies (CDC) recommandent actuellement aux femmes infectées par le VIH de ne pas allaiter leurs enfants.
Précautions liées aux effets cardiovasculaires
Des cas d’insuffisance cardiaque congestive, d’œdème périphérique et d’œdème pulmonaire ont été rapportés chez des patients immunodéprimés ou immunocompétents recevant de l’itraconazole par voie IV ou orale pour traiter des infections fongiques systémiques et chez des patients immunocompétents recevant des gélules d’itraconazole par voie orale pour traiter une onychomycose. Les capsules d’itraconazole ne doivent pas être utilisées pour traiter l’onychomycose chez les patients présentant des signes de dysfonctionnement ventriculaire, tels qu’une insuffisance cardiaque congestive, ou des antécédents d’insuffisance cardiaque congestive.
Pour d’autres indications (par exemple, le traitement des infections fongiques systémiques) chez les patients présentant des signes de dysfonctionnement ventriculaire, l’itraconazole IV ou oral ne doit être utilisé que lorsque les bénéfices l’emportent clairement sur les risques.
Les cliniciens doivent examiner attentivement les risques et les bénéfices du traitement par itraconazole chez les patients présentant des facteurs de risque d’insuffisance cardiaque congestive (par exemple, en cas de maladie cardiaque telle qu’une maladie ischémique ou valvulaire, de maladie pulmonaire cliniquement importante telle qu’une bronchopneumopathie chronique obstructive, ou d’insuffisance rénale et d’autres troubles œdémateux), et l’itraconazole IV et la solution orale d’itraconazole doivent être utilisés avec précaution chez ces patients.
Si l’administration d’itraconazole est jugée nécessaire chez des patients présentant des facteurs de risque d’insuffisance cardiaque congestive, ceux-ci doivent être informés des signes et symptômes de l’insuffisance cardiaque congestive et faire l’objet d’une surveillance attentive pendant le traitement. Les patients qui développent une insuffisance cardiaque congestive pendant qu’ils reçoivent des capsules orales d’itraconazole doivent arrêter le traitement. Si une insuffisance cardiaque congestive survient au cours d’un traitement par itraconazole IV ou par solution orale d’itraconazole, le patient doit être surveillé attentivement et les options thérapeutiques (y compris l’arrêt éventuel du médicament) doivent être évaluées.
L’itraconazole et son principal métabolite, l’hydroxyitraconazole, étant de puissants inhibiteurs du système isoenzyme 3A4 du cytochrome P-450 (CYP), l’utilisation concomitante de l’agent antifongique et de médicaments métabolisés par ces enzymes peut augmenter les concentrations plasmatiques de ces médicaments, ce qui peut entraîner une augmentation de leurs effets thérapeutiques et indésirables. Des effets cardiovasculaires indésirables graves (allongement de l’intervalle QT, torsades de pointes, tachycardie ventriculaire, arrêt cardiaque et/ou mort subite) ont été rapportés chez des patients recevant de l’itraconazole en même temps que certains médicaments métabolisés par les enzymes CYP3A4 (par exemple, le cisapride, le dofétilide, le pimozide, la quinidine), et l’utilisation concomitante de ces médicaments est contre-indiquée.
Précautions liées aux effets hépatiques
Étant donné que de rares cas d’hépatotoxicité grave ont été rapportés avec l’itraconazole, dont certains au cours de la première semaine de traitement, le traitement par l’itraconazole ne doit pas être utilisé chez les patients présentant une augmentation des enzymes hépatiques sériques, une maladie hépatique active ou des antécédents de toxicité hépatique avec d’autres médicaments, à moins que les bénéfices potentiels ne dépassent les risques. Les concentrations sériques d’enzymes hépatiques doivent être surveillées chez tout patient présentant des anomalies préexistantes de la fonction hépatique et chez ceux qui ont subi une toxicité hépatique avec d’autres médicaments.
En outre, la surveillance des enzymes hépatiques sériques doit être envisagée pour tous les patients recevant de l’itraconazole, en particulier ceux qui reçoivent un traitement continu à l’itraconazole pendant plus d’un mois. L’itraconazole doit être arrêté immédiatement et des tests de la fonction hépatique doivent être effectués si des signes et des symptômes compatibles avec une maladie hépatique apparaissent au cours du traitement. Les risques et les bénéfices de l’itraconazole doivent être réévalués chez ces patients. Les patients doivent être informés qu’ils doivent arrêter immédiatement l’itraconazole et contacter leur clinicien en cas d’apparition de signes ou de symptômes de dysfonctionnement hépatique, y compris une fatigue inhabituelle, des urines foncées, des selles pâles, une anorexie, des nausées, des vomissements ou un ictère, afin que des tests de laboratoire appropriés puissent être effectués.
Autres précautions et contre-indications
En cas de neuropathie pouvant être attribuée à l’itraconazole, le traitement doit être interrompu. L’itraconazole pouvant provoquer une hypokaliémie, certains cliniciens recommandent de surveiller les concentrations sériques de potassium chez les patients recevant des doses relativement élevées et/ou un traitement prolongé avec ce médicament. L’itraconazole est contre-indiqué chez les patients présentant une hypersensibilité connue au médicament ou à l’un des ingrédients de la formulation.
Bien que l’on ne dispose pas d’informations concernant la sensibilité croisée entre l’itraconazole et d’autres agents antifongiques triazoles ou imidazoles, le fabricant indique que l’itraconazole doit être utilisé avec prudence chez les personnes hypersensibles à d’autres azoles.
Précautions pédiatriques
La sécurité et l’efficacité de l’itraconazole chez les enfants de moins de 18 ans n’ont pas été établies. Un nombre limité de patients âgés de 3 à 16 ans souffrant d’infections fongiques systémiques non méningées ont reçu des capsules d’itraconazole à la dose de 100 mg par jour sans effets indésirables inhabituels. En outre, un nombre limité de patients pédiatriques âgés de 6 mois à 12 ans ont reçu une solution orale d’itraconazole à la dose de 5 mg/kg une fois par jour pendant 2 semaines sans effets indésirables inhabituels.
Cependant, des données issues d’études animales ont montré que l’itraconazole induit des anomalies osseuses chez les rats recevant des doses aussi faibles que 20 mg/kg par jour (2 fois la dose maximale recommandée chez l’homme). Ces anomalies comprennent une diminution de l’activité de la plaque osseuse, un amincissement de la zone compacte des grands os et une augmentation de la fragilité osseuse. À une dose de 80 mg/kg par jour (10 fois la dose maximale recommandée chez l’homme) pendant plus d’un an ou de 160 mg/kg par jour (20 fois la dose maximale recommandée chez l’homme), le médicament a provoqué l’apparition de petites pulpes dentaires d’aspect hypocellulaire chez certains rats.
Bien que la toxicité osseuse observée chez les animaux n’ait pas été signalée à ce jour chez les patients adultes recevant le médicament, l’effet à long terme du traitement à l’itraconazole chez les enfants n’est pas connu.
Précautions pour les personnes âgées
Les études cliniques sur l’itraconazole IV n’ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour déterminer si les patients gériatriques réagissent différemment des patients plus jeunes. Bien que d’autres expériences cliniques n’aient pas révélé de différences de réponse, la posologie du médicament doit être choisie avec prudence chez les patients gériatriques. Il convient également de tenir compte de la fréquence plus élevée de la diminution de la fonction hépatique, rénale et/ou cardiaque et des maladies et traitements médicamenteux concomitants observés chez les personnes âgées.
Mutagénicité et cancérogénicité
Aucun signe de mutagénicité n’a été observé lorsque l’itraconazole a été testé dans des systèmes d’essai bactériens, mammaliens et non mammaliens inappropriés. Aucun signe de cancérogénicité n’a été observé chez les souris recevant de l’itraconazole par voie orale pendant 23 mois à des doses allant jusqu’à 80 mg/kg par jour (environ 10 fois la dose maximale recommandée chez l’homme). Une légère augmentation de l’incidence des sarcomes des tissus mous a été observée chez les rats mâles recevant 25 mg/kg par jour (3,1 fois la dose maximale recommandée chez l’homme). Ces sarcomes peuvent être la conséquence d’une hypercholestérolémie, une réponse à l’administration chronique d’itraconazole observée chez les rats mais pas chez les chiens ou les humains.
Une augmentation de l’incidence du carcinome épidermoïde du poumon a été observée chez des rats femelles recevant 50 mg/kg d’itraconazole par jour (6,25 fois la dose maximale recommandée chez l’homme). Bien que l’apparition d’un carcinome épidermoïde du poumon soit extrêmement rare chez les rats non traités, l’augmentation de l’incidence dans cette étude n’était pas statistiquement significative. La solution orale d’itraconazole et l’injection d’itraconazole disponibles dans le commerce contiennent de l’hydroxypropyl-b-cyclodextrine (HP-b-CD) en tant qu’excipient. L’HP-b-CD a produit des adénocarcinomes pancréatiques dans des études de cancérogénicité chez le rat, mais des effets similaires n’ont pas été observés dans une étude de cancérogénicité chez la souris.
La pertinence clinique de ce résultat est inconnue. Sur la base de comparaisons de la surface corporelle, il a été estimé que les patients recevant la dose habituelle de la solution orale d’itraconazole disponible dans le commerce seraient exposés à des concentrations de HP-b-CD équivalentes à 1,7 fois l’exposition à la dose la plus faible utilisée dans l’étude sur les rats.
Il reste à déterminer si les résultats des études animales utilisant le HP-b-CD administré par voie orale s’appliquent à l’itraconazole administré par voie parentérale.
Autres caractéristiques du patient
Des effets indésirables dus à des interactions médicamenteuses ne sont pas attendus chez les patients diabétiques utilisant de l’insuline et des médicaments hypoglycémiants oraux qui ne sont pas métabolisés par le CYP3A4 (par exemple, le tolbutamide, le gliclazide, le glibenclamide, le glipizide et la metformine). Les données pharmacocinétiques et de sécurité issues des essais cliniques et de la surveillance post-commercialisation ont été examinées afin d’évaluer la sécurité de l’itraconazole chez les patients diabétiques atteints d’onychomycose ou de dermatomycose.
La surveillance post-commercialisation, comprenant tous les rapports d’effets indésirables chez les patients prenant de l’itraconazole en même temps que de l’insuline ou un médicament hypoglycémiant oral, a révélé 15 rapports suggérant une hyperglycémie et neuf rapports suggérant une hypoglycémie. Chez la plupart des patients, l’effet antidiabétique n’a pas changé. Des essais cliniques menés sur 189 patients diabétiques traités à l’itraconazole pour diverses infections ont révélé un effet indésirable lié à l’itraconazole, à savoir une aggravation du diabète chez un patient ayant subi une transplantation rénale et qui prenait également de la ciclosporine.
L’itraconazole a provoqué des anomalies du développement fœtal chez les rongeurs et est donc contre-indiqué pendant la grossesse.
L’itraconazole doit être évité chez les patients souffrant d’insuffisance hépatique. La fonction hépatique doit être surveillée si le traitement dure plus d’un mois ou en cas de symptômes évocateurs d’une hépatite. Le traitement doit être interrompu en cas d’anomalie de la fonction hépatique.
Les concentrations plasmatiques d’itraconazole doivent être surveillées chez les patients souffrant d’une maladie hépatique active et la posologie doit être ajustée si nécessaire. Des ajustements de la dose peuvent également être nécessaires chez certains patients souffrant d’insuffisance rénale. Les informations relatives au produit sous licence préviennent que l’utilisation de préparations intraveineuses d’itraconazole formulées avec de l’hydroxypropylbétadex est contre-indiquée chez les patients dont la clairance de la créatinine est inférieure à 30 ml/minute.
L’itraconazole doit être arrêté en cas d’apparition d’une neuropathie. Il ne doit pas être utilisé pour traiter des infections fongiques moins graves, telles que l’onychomycose, chez les patients présentant des signes ou des antécédents de dysfonctionnement ventriculaire, tel que l’insuffisance cardiaque. L’hypochlorhydrie, qui peut être présente chez les patients atteints du SIDA, peut réduire l’absorption de l’itraconazole. Dans ce cas, l’absorption peut être améliorée en administrant l’itraconazole avec une boisson acide, telle qu’une boisson au cola.
Ce médicament est disponible dans les pharmacies les plus courantes en France : Pharmacie Monge, Citypharma, Alphega Pharmacie, Pharmacie de France, et Pharmacie du Centre.
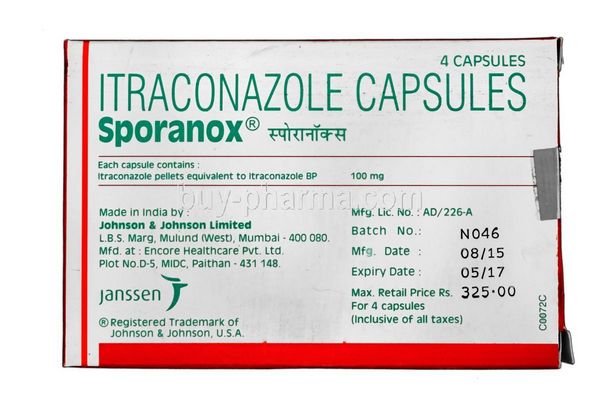
Médicaments similaires en France
Il existe plusieurs médicaments antifongiques similaires disponibles en France, notamment le Fluconazole (Diflucan) et le Voriconazole (Vfend). Ces médicaments sont également utilisés pour traiter les infections fongiques et partagent un mécanisme d’action similaire à celui de l’Itraconazole.
Préparations
| Forme posologique | Dosage | Nom de marque | Composition/Caractéristiques | Fabricant |
|---|---|---|---|---|
| Capsules orales | 100 mg | Sporanox® | Disponible en PulsePak® et en emballages réguliers | Janssen |
| Solution orale | 10 mg/mL | Sporanox® | Contient de l’hydroxypropyl-β-cyclodextrine (400 mg/mL) et du propylène glycol | Ortho Biotech |
| Parentéral pour injection | 10 mg/mL (250 mg de concentré pour 200 mg d’administration IV) | Sporanox® | Contient de l’hydroxypropyl-β-cyclodextrine (400 mg/mL), du propylène glycol et un diluant de chlorure de sodium à 0,9 % ; comprend un dispositif de perfusion filtrée | Ortho Biotech |
Autres noms de marque dans différents pays
| Pays | Noms de marque |
|---|---|
| Argentine | ITC, Itrac, Micotenk, Nitridazol, Panastat, Salimidin, Sporanox |
| Australie | Sporanox |
| Autriche | Itrabene, Sporanox |
| Belgique | Sporanox |
| Brésil | Es-tiranox, Fungonax, Itracotan, Itrahexal-H, Itranax, Itraspor, Itrazol, Neo Itrax, Sporanox, Spozol, Tracnox, Traconal, Traconax, Tracozon, Trana-zol, Tratzol, Traxonol |
| Canada | Sporanox |
| Chili | Itodal, Sporanox, Teramic |
| République tchèque | Cladostad, Prokanazol, Sporanox |
| Danemark | Niddazol, Sporanox |
| Finlande | Sporanox |
| France | Sporanox |
| Allemagne | Canifug, Itra, Itracol, Sempera, Siros |
| Grèce | Assosept-S, Bevonazole, Brovicton, Deratil, Etrel, Flunol, Idranox, Isoflon, Itrabest, Itracon, Itraconal, Itralfa, Itraviron, Itrazol, Laverio, Lorenzol, Mesmor, Micronazol, Prominox, Soprazon, Sporanox, Sporizole, Stas, Sterginox, Zetilox |
| Hong Kong | Aranox, Quali-itrazole, Sporanox |
| Hongrie | Cladostad, Omicral, Orungal |
| Inde | Candistat, Canditral, Itracan |
| Indonésie | Forcanox, Fungitrazol, Furolnok, Itzol, Nufatrac, Sporacid, Sporanox, Spyrocon, Trachon, Unitrac, Zitrazol |
| Irlande | Sporanox |
| Israël | Itranol, Sporanox |
| Italie | Sporanox, Trazer, Triasporin |
| Malaisie | Canditral, Inox, Sporanox, Unitrac |
| Mexique | Carexan, Conamed, Congox, Derusil, Ergospharma, Fitocyd, Fulzoltec, Fuzoltec, Imazol, Iqcona, Isoporum, Isox, Itranax, Lozartil, Rixtal, Seritral, Silicsan, Sinozol, Solmavin, Sporanox, Steitraz, Trax, Z-Fin, Zolken |
| Pays-Bas | Trisporal |
| Norvège | Sporanox |
| Nouvelle Zélande | Sporanox |
| Philippines | Sporanox |
| Pologne | Orungal, Trioxal |
| Portugal | Sporanox |
| Russie | Irunine, Orungal, Orungamin, Orunit, Rumycoz |
| Afrique du Sud | Adco-Sporozole, Sporanox |
| Singapour | Canditral, Sporanox |
| Espagne | Canadiol, Hongoseril, Oromic, Sporanox |
| Suède | Sporanox |
| Suisse | Sporanox |
| Thaïlande | Canditral, Icona, Itra, Itracon, Norspor, Spazol, Sporal, Sporlab, Spornar |
| Turquie | Funit, Itraspor, Sporex |
| Royaume-Uni | Sporanox |
| États-Unis d’Amérique | Sporanox |
| Venezuela | Fungosin, Sporanox |
Multi-ingrédients
- Mexique: Sepia Sporasec
- Venezuela: Sporasec
Commandez ce médicament en ligne et payez avec l’une des principales plateformes de paiement en ligne françaises, Paylib, Sepa Direct Debit, Cashway, Lydia, et Lyf Pay services.

