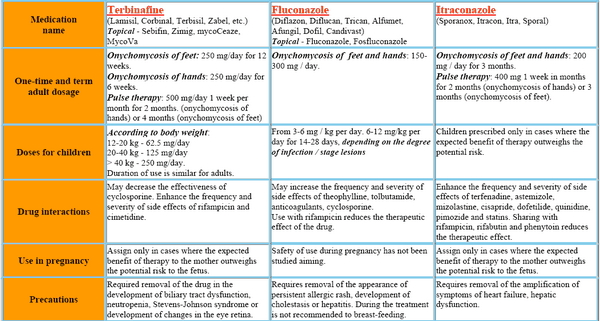
El itraconazol puede utilizarse para tratar diversas infecciones fúngicas superficiales, como las dermatofitosis, la pitiriasis versicolor y las formas mucosas y cutáneas de candidosis. También es eficaz en pacientes con infecciones subcutáneas, como la cromoblastomicosis, la esporotricosis y ciertas formas de feohifomicosis. Se ha convertido en el fármaco de elección para las formas no potencialmente mortales de blastomicosis e histoplasmosis y es una alternativa a la anfotericina B para la aspergilosis invasora.
Nomenclatura del fármaco
Clases Terapéuticas de Itraconazol
Agentes antifúngicos, Antifúngicos, Agentes antiprotozoarios, Antiprotozoarios.
Farmacopea Europea, 6ª ed. (Itraconazol)
Polvo blanco o casi blanco. Prácticamente insoluble en agua, ligeramente soluble en alcohol, libremente soluble en diclorometano, poco soluble en tetrahidrofurano. Proteger de la luz.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es la autoridad reguladora oficial en España responsable de la evaluación y aprobación de medicamentos, incluyendo Itraconazol
Farmacocinética
La absorción de itraconazol a partir del tracto gastrointestinal es incompleta (alrededor del 55%), pero mejora si el fármaco se administra con alimentos. La administración oral de una sola cápsula de 100 mg producirá concentraciones séricas máximas de entre 0,1 y 0,2 mg/l unas 2-4 h después. Se obtienen concentraciones más elevadas tras dosis repetidas, pero existe una marcada variación entre individuos. Al igual que ocurre con el ketoconazol, se produce un aumento desproporcionado de los niveles sanguíneos al aumentar la dosis. Las concentraciones séricas se reducen notablemente cuando la producción de ácido gástrico está alterada.
Se han alcanzado concentraciones sanguíneas mucho más elevadas (hasta 1,0-1,5 mg/1) en pacientes con SIDA e individuos neutropénicos tras la administración de una dosis de 5 mg/kg de la formulación en solución oral de itraconazol durante 1-2 semanas. Esta formulación se absorbe mejor si se administra sin alimentos.
Como la mayoría de los demás antifúngicos azólicos, la unión a proteínas del itraconazol es elevada, superior al 99% en el suero humano. En consecuencia, las concentraciones del fármaco en fluidos corporales como el LCR son mínimas. En cambio, las concentraciones del fármaco en tejidos como el pulmón, el hígado y los huesos son de dos a tres veces superiores a las del suero. También se encuentran altas concentraciones de itraconazol en el estrato córneo como resultado de la secreción del fármaco en el sebo. Se ha observado que el itraconazol persiste en la piel durante 2-4 semanas tras finalizar un tratamiento de 4 semanas. Persiste en las uñas de los pies hasta 6 meses después de finalizar un tratamiento de 3 meses, pero los niveles en las uñas de las manos disminuyen unos 3 meses después de finalizar el tratamiento.
Menos del 0,03% de una dosis administrada de itraconazol se excreta sin cambios en la orina, pero hasta el 18% se elimina en las heces como fármaco inalterado.
Estudios clínicos en España
En España, el itraconazol ha sido objeto de diversos estudios clínicos centrados en su eficacia y seguridad en el tratamiento de las infecciones fúngicas. Por ejemplo, los ensayos clínicos han evaluado su uso en onicomicosis (infecciones fúngicas de las uñas), evaluando resultados como las tasas de curación micológica y la tolerabilidad de los pacientes. En general, estos estudios han demostrado que el itraconazol es eficaz para erradicar los hongos patógenos de las uñas infectadas, con un perfil de seguridad favorable. Además, la investigación ha explorado su aplicación en infecciones fúngicas sistémicas, proporcionando información sobre los regímenes de dosificación óptimos y las duraciones de tratamiento específicas para la población española.
Los últimos acontecimientos en España han puesto de relieve la importancia de los programas de administración de antifúngicos para combatir las resistencias. Las autoridades sanitarias están haciendo hincapié en el uso prudente de antifúngicos como el itraconazol para preservar su eficacia. Además, la investigación en curso está explorando nuevas formulaciones para mejorar la biodisponibilidad y la adherencia del paciente.
La Dra. María González, especialista en enfermedades infecciosas del Hospital Clínico San Carlos de Madrid, ha debatido el papel del itraconazol en el tratamiento de las infecciones fúngicas sistémicas en conferencias médicas recientes. Sus conocimientos han contribuido a la actualización de las directrices clínicas sobre el tratamiento antifúngico en España.
Usos
El itraconazol está clasificado en España como medicamento de venta con receta. Los pacientes deben obtener una receta válida de un profesional sanitario autorizado para acceder a este tratamiento antifúngico
Las cápsulas de itraconazol IV y oral se utilizan para tratar infecciones fúngicas sistémicas en pacientes inmunodeprimidos e inmunocompetentes. Entre ellas se incluyen la blastomicosis (pulmonar y extrapulmonar), la histoplasmosis (incluida la enfermedad pulmonar cavitaria crónica y la enfermedad diseminada no meníngea) y la aspergilosis (pulmonar y extrapulmonar en pacientes que no responden a la anfotericina B o no la toleran).
La solución oral de itraconazol (pero no las cápsulas de itraconazol) se utiliza para el tratamiento de la candidiasis orofaríngea y esofágica. El itraconazol (administrado inicialmente por vía intravenosa seguido de itraconazol en solución oral) se utiliza como tratamiento antifúngico empírico en pacientes neutropénicos febriles. Las cápsulas orales de itraconazol se utilizan en individuos inmunocompetentes para el tratamiento de la tinea unguium (onicomicosis) de la uña del pie y/o de la uña de la mano causada por dermatofitos.

El itraconazol también se utiliza por vía oral para la prevención de infecciones fúngicas graves (por ejemplo, coccidioidomicosis, criptococosis, histoplasmosis, candidiasis mucocutánea) en pacientes con infección por el virus de la inmunodeficiencia humana (VIH). Antes de iniciar el tratamiento con itraconazol IV o itraconazol oral en cápsulas para el tratamiento de infecciones fúngicas sistémicas, deben obtenerse muestras apropiadas para cultivo fúngico y otros estudios de laboratorio relevantes (montaje húmedo, histopatología, serología) con el fin de aislar e identificar el organismo u organismos causantes. El tratamiento con itraconazol puede iniciarse a la espera de los resultados de estas pruebas in vitro; sin embargo, una vez que se disponga de los resultados, el tratamiento deberá ajustarse en consecuencia. Antes de iniciar el tratamiento con cápsulas orales de itraconazol para la onicomicosis, deben obtenerse muestras de uñas apropiadas para estudios microbiológicos (por ejemplo, preparación de hidróxido de potasio [KOH], cultivo fúngico, biopsia de uña) para confirmar el diagnóstico.
Aspergilosis
El itraconazol se utiliza en el tratamiento de la aspergilosis pulmonar y extrapulmonar en pacientes que no toleran o son refractarios a la anfotericina B IV. La anfotericina B IV se considera generalmente el tratamiento de elección para la aspergilosis invasora, especialmente para las infecciones graves y potencialmente mortales, y el itraconazol es un agente alternativo. En un número limitado de pacientes con aspergilosis invasora que no respondieron o no pudieron tolerar la anfotericina B IV, las cápsulas orales de itraconazol (200-400 mg diarios administrados durante una duración media del tratamiento de 3-4 meses) han sido eficaces como tratamiento de segunda línea.
Blastomicosis
El itraconazol se utiliza en el tratamiento de la blastomicosis pulmonar y extrapulmonar causada por Blastomyces dermatitidis. Aunque tanto las cápsulas orales de itraconazol como la anfotericina B IV se consideran fármacos de elección para el tratamiento de la blastomicosis, se prefiere la anfotericina B para el tratamiento de infecciones graves, especialmente las que afectan al SNC. La anfotericina B IV también suele preferirse para el tratamiento inicial de la presunta blastomicosis en pacientes inmunodeprimidos, incluidos los infectados por el VIH. Muchos médicos consideran que el itraconazol oral es el fármaco de elección para el tratamiento de la blastomicosis no meníngea que no pone en peligro la vida, incluidas las infecciones diseminadas leves a moderadas sin afectación del SNC, y también recomiendan el fármaco para el tratamiento de seguimiento en pacientes con infecciones más graves después de haber obtenido una respuesta inicial con anfotericina B IV.
Se han notificado fracasos del tratamiento cuando se utilizó un agente antifúngico oral (por ejemplo, ketoconazol) para tratar la blastomicosis cutánea o pulmonar en pacientes que presentaban afectación asintomática o subclínica del SNC en el momento del diagnóstico inicial. Esto debe tenerse en cuenta al seleccionar un agente antifúngico para los pacientes con blastomicosis. Algunos clínicos afirman que los antifúngicos azólicos no deben utilizarse para el tratamiento primario de pacientes con blastomicosis del SNC.
Histoplasmosis
El itraconazol se utiliza en el tratamiento de la histoplasmosis, incluida la enfermedad pulmonar cavitaria crónica y la enfermedad diseminada no meníngea. Tanto la anfotericina B IV como las cápsulas orales de itraconazol se consideran fármacos de elección para el tratamiento de la histoplasmosis. Sin embargo, la anfotericina B IV suele preferirse para el tratamiento inicial de la histoplasmosis grave y potencialmente mortal, especialmente en pacientes inmunodeprimidos como los infectados por el VIH.
El itraconazol oral se utiliza generalmente en el tratamiento inicial de infecciones leves a moderadas (por ejemplo, en pacientes que no requieren hospitalización) o como terapia de seguimiento en el tratamiento de infecciones graves después de haber obtenido una respuesta con anfotericina B. El itraconazol se ha utilizado para el tratamiento de la histoplasmosis diseminada en pacientes con infección por VIH.
El fabricante afirma que los datos de un número limitado de pacientes indican que la tasa de respuesta de la histoplasmosis al tratamiento con itraconazol en individuos infectados por el VIH es similar a la de los pacientes no infectados por este virus. Sin embargo, el curso clínico de la histoplasmosis en individuos infectados por el VIH suele ser más grave y normalmente requiere un tratamiento de mantenimiento a largo plazo para evitar recaídas. Se están llevando a cabo estudios para establecer la seguridad y eficacia del fármaco en el tratamiento de esta infección en individuos infectados por el VIH, incluida la investigación de la dosis óptima y la duración de la terapia de mantenimiento. El itraconazol oral se considera el fármaco de elección para la profilaxis primaria y la terapia supresora o de mantenimiento a largo plazo (profilaxis secundaria) para prevenir la recurrencia o recaída de la histoplasmosis en individuos infectados por el VIH. (Véase Usos: Prevención de infecciones fúngicas en individuos infectados por el VIH)
Candidiasis orofaríngea y esofágica
Debido a que los efectos tópicos y la exposición al fármaco pueden ser mayores con la solución oral que con las cápsulas de itraconazol, sólo debe utilizarse itraconazol solución oral para el tratamiento de la candidiasis orofaríngea y esofágica. En 2 estudios controlados en pacientes con candidiasis orofaríngea (el 92% estaban infectados por el VIH), se alcanzó una respuesta clínica (definida como curada o mejorada) en el 71-84% de los pacientes que recibieron itraconazol solución oral. Existen pruebas de que la solución oral de itraconazol es al menos tan eficaz como los comprimidos orales de fluconazol y puede ser más eficaz que las pastillas orales de clotrimazol para el tratamiento de la candidiasis orofaríngea. La solución oral de itraconazol ha sido eficaz para tratar la candidiasis orofaríngea en algunos pacientes, incluidos algunos individuos infectados por el VIH, que no respondieron al fluconazol oral.
Esporotricosis
Este medicamento se utiliza para tratar la esporotricosis. Aunque el itraconazol oral puede ser eficaz en pacientes con esporotricosis pulmonar o diseminada de leve a moderada, la anfotericina B intravenosa es el fármaco de elección para el tratamiento inicial de las infecciones graves y potencialmente mortales y siempre que haya afectación del SNC. El itraconazol oral se considera generalmente el fármaco de elección para el tratamiento de la esporotricosis cutánea, linfocutánea, pulmonar leve u osteoarticular y para el tratamiento de seguimiento en infecciones más graves después de haber obtenido una respuesta con anfotericina B IV.
Dado que la esporotricosis en pacientes inmunodeprimidos (por ejemplo, personas infectadas por el VIH) es especialmente agresiva y difícil de tratar, la anfotericina B IV es probablemente el fármaco de elección para el tratamiento inicial en estos pacientes; sin embargo, se producen fracasos terapéuticos. Algunos médicos recomiendan que las personas infectadas por el VIH que han recibido tratamiento para la esporotricosis reciban itraconazol oral como terapia supresora o de mantenimiento de por vida para prevenir la recaída; esta profilaxis no se aborda en las directrices actuales del Servicio de Salud Pública de EE.UU. y la Sociedad de Enfermedades Infecciosas de América (USPHS/IDSA) para la prevención de infecciones oportunistas en personas infectadas por el VIH.
Onicomicosis
Las cápsulas orales de itraconazol se utilizan en individuos inmunocompetentes para el tratamiento de la onicomicosis de las uñas de los pies (con o sin afectación de las uñas de las manos) y la onicomicosis de las uñas de las manos causada por dermatofitos (tinea unguium).
Antes de la administración de cápsulas de itraconazol para el tratamiento de la onicomicosis, deben obtenerse muestras apropiadas de las uñas para realizar estudios microbiológicos (por ejemplo, preparación de hidróxido de potasio [KOH], cultivo fúngico, biopsia de la uña) para confirmar el diagnóstico. En estudios doble ciego controlados con placebo en pacientes con onicomicosis de las uñas de los pies, el itraconazol oral (200 mg en cápsulas administrados una vez al día durante 12 semanas consecutivas) produjo una curación micológica en el 54% de los pacientes; el 35% se consideró un éxito global (curación micológica más afectación ungueal clara o mínima con una disminución significativa de los signos) y el 14% tuvo curación micológica más curación clínica (desaparición de todos los signos, con o sin deformidad ungueal residual).
El tiempo medio hasta el éxito global fue de aproximadamente 10 meses; sin embargo, el 21% de los que se consideraron un éxito global tuvieron una recaída de la onicomicosis. En un estudio doble ciego controlado con placebo en pacientes con onicomicosis de las uñas de las manos, el itraconazol oral administrado en un régimen de dosis en pulsos (200 mg en cápsulas dos veces al día durante la primera semana, sin itraconazol durante las semanas 2-4 y 200 mg en cápsulas dos veces al día durante la quinta semana) produjo una curación micológica en el 61% de los pacientes; el 56% se consideró un éxito global y el 47% tuvo curación micológica más curación clínica. El tiempo medio hasta el éxito global fue de aproximadamente 5 meses; no hubo recaídas en los que se consideraron un éxito global.
Paracoccidioidomicosis
Las cápsulas orales de itraconazol se utilizan en el tratamiento de la paracoccidioidomicosis (blastomicosis sudamericana) causada por Paracoccidioides brasiliensis y se consideran un fármaco de elección para el tratamiento de esta infección. Aunque no se ha identificado el régimen más eficaz para el tratamiento de la paracoccidioidomicosis en personas infectadas por el VIH, algunos médicos sugieren que estos pacientes reciban un tratamiento inicial con anfotericina B IV, y que se utilice un agente menos tóxico (por ejemplo, cápsulas orales de itraconazol), (p. ej., cápsulas orales de itraconazol, cotrimoxazol) como tratamiento supresor a largo plazo para la profilaxis de recidivas o recaídas; esta profilaxis no se aborda en las directrices actuales recomendadas por el USPHS/IDSA para la prevención de infecciones oportunistas en personas infectadas por el VIH.
Coccidioidomicosis y criptococosis
Aunque no se considera un fármaco de primera elección, las cápsulas orales de itraconazol se utilizan como agente alternativo para el tratamiento de la coccidioidomicosis o la criptococosis. Las cápsulas de itraconazol también se utilizan como agente alternativo para la profilaxis primaria de la criptococosis o como terapia supresora o de mantenimiento para prevenir la recurrencia o recaída de la coccidioidomicosis o la criptococosis en individuos infectados por el VIH.
Cromomicosis
Las cápsulas orales de itraconazol se han utilizado con cierto éxito para el tratamiento de la cromomicosis (cromoblastomicosis) causada por diversos hongos dematiáceos (por ejemplo, Cladosporium, Exophiala, Fonsecaea, Phialophora).
Basidiobolomicosis
El itraconazol oral se ha utilizado en un número limitado de pacientes para tratar la basidiobolomicosis GI, una zigomicosis causada por Basidiobolus ranarum. B. ranarum se ha aislado en todo el mundo de la vegetación y el suelo en descomposición y del tracto gastrointestinal de reptiles, anfibios, peces y murciélagos insectívoros (incluso en EE.UU.). La basidiobolomicosis es más frecuente en regiones tropicales y subtropicales como África oriental y occidental, y la infección suele manifestarse en forma de nódulos subcutáneos indoloros en las extremidades, el tronco o las nalgas, secundarios a una inoculación traumática.
Las infecciones gastrointestinales son extremadamente raras y posiblemente el resultado de la ingestión de tierra contaminada (especialmente cerca de ríos o lagos) o frutas o verduras contaminadas con tierra o heces de reptiles o anfibios infectados. Desde abril de 1994 hasta mayo de 1999, se identificaron 7 casos de basidiobolomicosis GI en Arizona. La mayoría de los casos de basidiobolomicosis GI se han tratado con éxito con itraconazol oral (400 mg diarios administrados durante 3-19 meses) tras la resección quirúrgica parcial del tracto GI; sin embargo, no está claro si se habría obtenido una respuesta clínica si se hubiera utilizado itraconazol solo sin intervención quirúrgica. Aunque también se ha informado de que el ketoconazol fue eficaz en al menos un paciente, la anfotericina B ha sido ineficaz para el tratamiento de la basidiobolomicosis GI en varios pacientes.
Terapia empírica en pacientes neutropénicos febriles
El itraconazol (administrado inicialmente por vía intravenosa seguido de itraconazol en solución oral) se utiliza para el tratamiento empírico de presuntas infecciones fúngicas en pacientes neutropénicos febriles. La seguridad y eficacia del itraconazol para esta indicación se han evaluado en un estudio abierto y aleatorizado en adultos neutropénicos febriles con neoplasias hematológicas; los pacientes recibieron itraconazol (200 mg IV dos veces al día durante 2 días, luego 200 mg IV una vez al día de los días 3 a 14 seguidos de itraconazol en solución oral 200 mg dos veces al día para completar hasta 28 días de tratamiento) o anfotericina B IV convencional (0,7-1 mg/kg al día durante un máximo de 28 días). La tasa de éxito terapéutico (definida como la supervivencia del paciente con resolución de la fiebre y la neutropenia en los 28 días siguientes al tratamiento, ausencia de infecciones fúngicas emergentes, uso del fármaco del estudio sin interrupción prematura por toxicidad o falta de eficacia, y tratamiento durante 3 o más días) fue del 47% para el itraconazol y del 38% para la anfotericina B (análisis por intención de tratar). Aunque la tasa de respuesta global fue mayor en los que recibieron itraconazol, un mayor número de pacientes que recibieron itraconazol interrumpieron el fármaco por fiebre persistente o cambiaron de tratamiento antifúngico por fiebre, y un mayor número de pacientes que recibieron anfotericina B interrumpieron el fármaco por intolerancia.
Prevención de las infecciones fúngicas en personas infectadas por el VIH
El itraconazol oral se utiliza en pacientes seleccionados con infección por VIH como profilaxis primaria frente a la criptococosis o la histoplasmosis y como tratamiento supresor o de mantenimiento a largo plazo (profilaxis secundaria) para prevenir la recurrencia o recaída de la coccidioidomicosis, la criptococosis, la histoplasmosis o la candidiasis mucocutánea.
El Grupo de Trabajo de Prevención de Infecciones Oportunistas del USPHS/IDSA ha establecido directrices para la prevención de infecciones oportunistas, incluidas las infecciones fúngicas, en personas infectadas por el VIH. Estas directrices incluyen recomendaciones relativas a la prevención de la exposición a patógenos oportunistas, la prevención de los primeros episodios de la enfermedad y la prevención de la recurrencia de la enfermedad. El USPHS/IDSA afirma que no se recomienda la profilaxis primaria para prevenir los primeros episodios de candidiasis mucocutánea en adultos, adolescentes, lactantes y niños infectados por el VIH.
Aunque no se recomienda la profilaxis primaria sistemática para prevenir los primeros episodios de coccidioidomicosis, criptococosis o histoplasmosis en adultos, adolescentes, lactantes y niños infectados por el VIH, el USPHS/IDSA afirma que la profilaxis primaria contra la criptococosis o la histoplasmosis puede considerarse en determinadas personas seleccionadas. El USPHS/IDSA recomienda que los adultos, adolescentes, lactantes y niños infectados por el VIH que hayan completado la terapia inicial para la coccidioidomicosis, criptococosis o histoplasmosis documentada reciban una terapia supresora o de mantenimiento a largo plazo (profilaxis secundaria) para prevenir la recurrencia o recaída de estas infecciones fúngicas.
Además, el USPHS/IDSA afirma que las personas infectadas por el VIH que presentan recidivas frecuentes o graves de candidiasis mucocutánea pueden beneficiarse de una terapia supresora o de mantenimiento a largo plazo (profilaxis secundaria). Debido a la preocupación que suscita el uso de antifúngicos azólicos orales durante el embarazo, el itraconazol no debe utilizarse como profilaxis primaria ni como tratamiento supresor o de mantenimiento crónico en mujeres embarazadas. Si una mujer se queda embarazada mientras recibe itraconazol como profilaxis y decide continuar con el embarazo, debe interrumpirse el tratamiento.
Se recomiendan medidas anticonceptivas eficaces para todas las mujeres infectadas por el VIH que reciban un agente antifúngico azólico oral como terapia supresora. La anfotericina B IV convencional puede ser el agente preferido si está indicada una terapia supresora o de mantenimiento a largo plazo contra la coccidioidomicosis, la criptococosis o la histoplasmosis en una mujer embarazada infectada por el VIH, especialmente durante el primer trimestre.
Profilaxis primaria
La seguridad y eficacia del itraconazol oral para la profilaxis primaria de infecciones fúngicas graves en individuos infectados por el VIH se ha evaluado en un estudio prospectivo, aleatorizado y controlado con placebo en 149 pacientes con infección avanzada por el VIH. La profilaxis fracasó en el 19% de los pacientes que recibieron itraconazol oral (200 mg una vez al día) y en el 29% de los que recibieron placebo. Los fracasos de la profilaxis relacionados con infecciones fúngicas invasivas (histoplasmosis, criptococosis, aspergilosis) fueron más frecuentes en los que recibieron placebo que en los que recibieron itraconazol; sin embargo, la incidencia de fracaso de la profilaxis debido a candidiasis mucosa recurrente o refractaria fue similar en ambos grupos. Aunque la profilaxis con itraconazol retrasó significativamente el tiempo de aparición de la histoplasmosis y la criptococosis, no se demostró un beneficio en la supervivencia de los que recibieron el fármaco.
Criptococosis
El USPHS/IDSA afirma que, aunque no se recomienda la profilaxis primaria sistemática contra la criptococosis, puede considerarse la profilaxis primaria en adultos y adolescentes infectados por el VIH con recuentos de linfocitos T CD4 inferiores a 50/mm3 y en lactantes y niños con inmunosupresión grave (según criterios ajustados por edad). No se recomienda la profilaxis sistemática debido a la relativa infrecuencia de la enfermedad criptocócica, a la falta de pruebas del beneficio para la supervivencia asociado a la profilaxis, así como a otras preocupaciones (p. ej., posibilidad de interacciones farmacológicas, potencial de desarrollo de resistencias, consideraciones de coste).
La necesidad de profilaxis primaria o terapia supresora contra otras infecciones fúngicas (por ejemplo, coccidioidomicosis, histoplasmosis, candidiasis mucocutánea) debe tenerse en cuenta al tomar la decisión relativa a la profilaxis contra la criptococosis. No se recomienda realizar pruebas rutinarias del antígeno criptocócico en suero en individuos asintomáticos debido a la escasa probabilidad de que los resultados afecten a las decisiones clínicas. Los individuos infectados por el VIH no pueden evitar por completo la exposición a Cryptococcus neoformans; no hay pruebas de que la exposición a excrementos de paloma se asocie a un mayor riesgo de criptococosis. El fluconazol oral es el agente de elección para la profilaxis primaria frente a la criptococosis en adultos, adolescentes, lactantes y niños infectados por el VIH, y el itraconazol oral (administrado en cápsulas) se considera una alternativa.
Histoplasmosis
El USPHS/IDSA afirma que la profilaxis primaria contra la histoplasmosis puede considerarse en adultos o adolescentes infectados por el VIH con recuentos absolutos de células T auxiliares/inductoras (CD4 , T4 ) inferiores a 100/mm3 que presenten un riesgo especialmente elevado de exposición a Histoplasma capsulatum debido a la exposición ocupacional o que vivan en una comunidad con una tasa hiperendémica de histoplasmosis (al menos 10 casos/100 pacientes-año) y también puede considerarse en lactantes o niños infectados por el VIH con inmunosupresión grave (según los criterios ajustados por edad) que vivan en zonas endémicas de histoplasmosis.
A la hora de decidir si utilizar profilaxis primaria contra la histoplasmosis en estas personas infectadas por el VIH, los clínicos deben tener en cuenta la incidencia local de histoplasmosis, la posibilidad de interacciones farmacológicas, la toxicidad, el desarrollo de resistencias, el coste y la necesidad de profilaxis contra otras infecciones fúngicas (por ejemplo, candidiasis, criptococosis).
Las pruebas cutáneas sistemáticas con histoplasmina o las pruebas serológicas de anticuerpos o antígenos de histoplasmosis en personas infectadas por el VIH que viven en zonas endémicas de histoplasmosis no predicen la enfermedad y no se recomiendan. Aunque las personas infectadas por el VIH que viven o visitan zonas donde la histoplasmosis es endémica no pueden evitar por completo la exposición a H. capsulatum, las que tienen recuentos de linfocitos T CD4 inferiores a 200/mm3 deben evitar las actividades que se sabe que están asociadas a un mayor riesgo (por ejemplo, levantar polvo al trabajar con la superficie del suelo; limpiar gallineros muy contaminados con excrementos; remover el suelo debajo de los nidos de aves; limpiar, remodelar o demoler edificios antiguos; explorar cuevas). El itraconazol oral (administrado en cápsulas) es el agente de elección para la profilaxis primaria contra la histoplasmosis en adultos, adolescentes o pacientes pediátricos infectados por el VIH; el USPHS/IDSA no recomienda ninguna alternativa al itraconazol.
Prevención de la recurrencia
Coccidioidomicosis: Para la terapia supresora o de mantenimiento a largo plazo (profilaxis secundaria) para prevenir la recurrencia o recaída en adultos, adolescentes, lactantes y niños infectados por el VIH con coccidioidomicosis documentada que ha sido tratada adecuadamente, el USPHS/IDSA recomienda fluconazol oral como fármaco de elección y anfotericina B IV o itraconazol oral (administrado en cápsulas) como alternativas. El tratamiento supresor o de mantenimiento a largo plazo para la profilaxis de la recidiva o recaída de la coccidioidomicosis en personas infectadas por el VIH suele prolongarse de por vida. Aunque las personas infectadas por el VIH que reciben profilaxis antifúngica supresora contra la coccidioidomicosis pueden tener un riesgo bajo de recurrencia de esta infección fúngica si su recuento de células T CD4 aumenta a más de 100/mm3 mientras reciben un tratamiento antirretroviral combinado potente, el USPHS/IDSA afirma que los datos son insuficientes hasta la fecha para justificar una recomendación sobre la interrupción de la profilaxis en estas personas.
Criptococosis: Para la terapia supresora o de mantenimiento a largo plazo (profilaxis secundaria) para prevenir la recurrencia o recaída en adultos, adolescentes, lactantes y niños infectados por el VIH con criptococosis documentada que ha sido tratada adecuadamente, el USPHS/IDSA recomienda el fluconazol oral como fármaco de elección y la anfotericina B intravenosa o el itraconazol oral (administrado en cápsulas) como alternativas.
La terapia supresora o de mantenimiento (profilaxis secundaria) para prevenir la recurrencia o recaída de la criptococosis en individuos infectados por el VIH suele continuarse de por vida, a menos que se haya producido una recuperación inmunitaria como resultado de una terapia antirretroviral potente.
Histoplasmosis: Para la terapia supresora o de mantenimiento a largo plazo para prevenir la recurrencia o recaída en adultos, adolescentes, lactantes y niños infectados por el VIH con histoplasmosis documentada que ha sido tratada adecuadamente, el USPHS/IDSA recomienda el itraconazol oral (administrado en cápsulas) como fármaco de elección y la anfotericina B intravenosa como alternativa. La terapia supresora o de mantenimiento a largo plazo contra la histoplasmosis en personas infectadas por el VIH suele prolongarse de por vida. Aunque los pacientes que reciben profilaxis antifúngica supresora pueden tener un riesgo bajo de recurrencia de la histoplasmosis si sus recuentos de células T CD4 aumentan a más de 100/mm3 mientras reciben un tratamiento antirretroviral combinado potente, el USPHS/IDSA afirma que los datos disponibles hasta la fecha son insuficientes para recomendar la interrupción de la profilaxis en estas personas.
Candidiasis mucocutánea: El USPHS/IDSA recomienda la terapia supresora o de mantenimiento a largo plazo para adultos y adolescentes con antecedentes de candidiasis esofágica documentada (especialmente con múltiples episodios), teniendo en cuenta el potencial de desarrollo de cepas resistentes de Candida. Además, el USPHS/IDSA recomienda la terapia supresora para lactantes y niños con candidiasis mucocutánea grave y recurrente, especialmente aquellos con candidiasis esofágica.
Aunque muchos expertos no recomiendan la terapia supresora a largo plazo de la candidiasis orofaríngea o vulvovaginal recurrente, por las mismas razones no recomiendan la profilaxis primaria contra la candidiasis. El USPHS/IDSA afirma que la terapia supresora contra la candidiasis puede considerarse en individuos infectados por el VIH con recurrencias frecuentes o graves de estas infecciones.
Sin embargo, deben tenerse en cuenta varios factores a la hora de considerar dicha terapia, como el impacto de las recurrencias en el bienestar y la calidad de vida del paciente, la necesidad de profilaxis contra otras infecciones fúngicas, el coste de la profilaxis, las toxicidades de los fármacos, las interacciones farmacológicas y el potencial de desarrollo de farmacorresistencia entre Candida y otros hongos. Si está indicado un tratamiento supresor o de mantenimiento a largo plazo en adultos, adolescentes, lactantes o niños infectados por el VIH con recurrencias frecuentes o graves de candidiasis orofaríngea, esofágica o vaginal, el USPHS/IDSA recomienda el fluconazol oral como fármaco de elección y el itraconazol (administrado como solución oral) como alternativa.
Administración
El itraconazol se administra por vía oral o mediante infusión intravenosa.
Itraconazol está disponible en España en las siguientes formulaciones
-
Cápsulas, 100 mg.
-
Solución oral, 10 mg/mL.
Estas formas permiten una flexibilidad en la administración, dependiendo del tipo y gravedad de la infección fúngica.
Administración oral
La biodisponibilidad del itraconazol oral varía en función de si el fármaco se administra en cápsulas o como solución oral, y el fabricante indica que estas preparaciones no deben utilizarse indistintamente. La solución oral de itraconazol (no las cápsulas de itraconazol) está indicada para el tratamiento de la candidiasis orofaríngea o esofágica. Mientras que la solución oral de itraconazol debe administrarse sin alimentos si es posible, las cápsulas de itraconazol deben administrarse con una comida completa para asegurar la máxima absorción del fármaco. Debe tenerse en cuenta la posibilidad de que la absorción gastrointestinal del fármaco disminuya en pacientes con hipoclorhidria, que se ha descrito en personas infectadas por el VIH.
Infusión IV
El itraconazol comercial inyectable debe diluirse antes de la perfusión intravenosa. Todo el contenido de una ampolla que contenga itraconazol inyectable (250 mg) debe agregarse al diluyente para inyección de cloruro de sodio al 0,9% (50 mL) proporcionado por el fabricante para obtener una solución que contenga 3,33 mg/mL en un volumen resultante de 75 mL.
Para garantizar la máxima seguridad y eficacia, la solución de itraconazol debe prepararse y administrarse correctamente. Debe utilizarse la proporción adecuada de itraconazol y diluyente, y debe mantenerse una concentración final de 3,33 mg/mL para proporcionar una mezcla estable y evitar la formación de un precipitado.
Siempre que la solución y el envase lo permitan, la inyección de Itraconazol y las soluciones diluidas del medicamento deben inspeccionarse visualmente para detectar partículas y decoloración antes de la administración. Para proporcionar una dosis de 200 mg de itraconazol, la solución diluida debe mezclarse suavemente, y luego deben extraerse y desecharse 15 mL. Los 60 mL restantes de la solución diluida que contiene 3.33 mg/mL deben administrarse por infusión IV durante 60 minutos.
La infusión debe administrarse usando un dispositivo de infusión controlada, el equipo de infusión proporcionado por el fabricante y una línea IV dedicada. El itraconazol no debe mezclarse con otros medicamentos y no debe administrarse por la misma vía IV que otros medicamentos. Una vez finalizada la infusión, el fabricante recomienda que el equipo de infusión se lave a través de la llave de paso de 2 vías con 15-20 ml de cloruro sódico al 0,9% inyectado durante 30 segundos a 15 minutos; a continuación, se debe desechar toda la vía intravenosa. No debe utilizarse solución bacteriostática de cloruro sódico para el lavado, ya que se desconoce la compatibilidad de la solución de itraconazol con soluciones de lavado distintas a la de cloruro sódico al 0,9%.
Dosificación
Debido a las diferencias en la biodisponibilidad oral, las cápsulas de itraconazol y la solución oral no deben utilizarse indistintamente mg por mg.
La dosificación de las cápsulas de itraconazol debe basarse en el tipo y la gravedad de la infección, la identidad del organismo causante y la respuesta del paciente al tratamiento. El fármaco parece sufrir un metabolismo saturable en el hígado; por lo tanto, los aumentos de la dosis pueden dar lugar a aumentos más que proporcionales de las concentraciones plasmáticas.
Para el tratamiento de infecciones fúngicas sistémicas potencialmente mortales, el itraconazol IV o las cápsulas orales de itraconazol deben iniciarse utilizando una dosis de carga. Si se utiliza inicialmente itraconazol IV, la dosis de carga recomendada en adultos es de 200 mg IV dos veces al día durante 4 dosis consecutivas seguidas de 200 mg una vez al día a partir de entonces.
Aunque los estudios clínicos que evalúan la seguridad y eficacia de las cápsulas orales de itraconazol no incluyeron una dosis de carga, basándose en consideraciones farmacocinéticas, el fabricante y algunos médicos afirman que las cápsulas orales de itraconazol deben iniciarse en infecciones potencialmente mortales en adultos utilizando una dosis de carga inicial de 200 mg tres veces al día (600 mg diarios) durante los tres o cuatro primeros días de tratamiento. El tratamiento posterior puede continuarse con la dosis oral habitual de 200-400 mg al día.
El fabricante afirma que el tratamiento con itraconazol debe continuarse durante al menos tres meses hasta que los parámetros clínicos y las pruebas de laboratorio indiquen que la infección fúngica activa ha remitido. Algunos médicos afirman que, si bien no se ha establecido la duración óptima del tratamiento para las infecciones fúngicas graves, el tratamiento con itraconazol probablemente debería continuarse durante al menos 12 meses para la histoplasmosis pulmonar diseminada o crónica y durante 6-12 meses para la blastomicosis. Un periodo inadecuado de tratamiento puede dar lugar a la recurrencia de la infección activa.
| Afección | Dosis | Vía de administración | Duración |
|---|---|---|---|
| Aspergilosis pulmonar/extrapulmonar | 200-400 mg al día; pueden utilizarse dosis más altas (hasta 600 mg) en casos invasivos | Oral/IV | IV: 200 mg dos veces al día durante 4 dosis, después 200 mg una vez al día; Oral: según necesidad |
| Blastomicosis/Histoplasmosis | Inicial: 200 mg una vez al día; aumentar en incrementos de 100 mg hasta un máximo de 400 mg al día | Oral/IV | Al menos 6 meses para la blastomicosis; 12-24 meses para la histoplasmosis crónica |
| Candidiasis orofaríngea | 100 mg/día para no comprometidos; 200-400 mg/día para pacientes neutropénicos | Solución oral | Mínimo 3 semanas |
| Candidiasis esofágica | 100 mg (10 mL) al día, puede aumentarse a 200 mg (20 mL) al día en función de la respuesta | Solución oral | Mínimo 3 semanas |
| Candidosis vaginal | Dos dosis de 200 mg tomadas con un intervalo de 6-8 horas | Oral | Tratamiento en un solo día |
| Esporotricosis | 100-200 mg una vez al día para infecciones cutáneas; 200 mg dos veces al día para osteoarticulares | Oral | 3-6 meses para cutáneas; 12 meses para osteoarticulares |
| Onicomicosis | 200 mg una vez al día para las uñas de los pies (12 semanas); dosis en pulsos de 400 mg una vez al día durante una semana cada mes durante 3 meses | Vía oral | Varía según el régimen |
| Terapia empírica en pacientes neutropénicos febriles | IV: 200 mg dos veces al día durante 4 dosis, luego disminuir a 200 mg una vez al día; oral: 200 mg (20 mL) dos veces al día hasta la recuperación | IV/Oral | Hasta 14 días IV, luego oral hasta recuperación |
| Dermatofitosis cutáneas | 100 mg/día | Oral | Tinea corporis/cruris: 2 semanas; Tinea pedis/manuum: 4 semanas |
| Pitiriasis versicolor | 200 mg/día | Oral | 1 semana |
| Infección fúngica subcutánea/profunda | 200-400 mg/día; pueden utilizarse dosis de carga de hasta 600 mg/día para infecciones potencialmente mortales | Oral | Continuo según sea necesario |
| Terapia de mantenimiento a largo plazo en pacientes con SIDA | Histoplasmosis/Criptococosis: 200 mg/día; Pacientes neutropénicos 400 mg/día | Oral |
Generalmente continuado de por vida
|
Prevención de infecciones fúngicas en individuos infectados por el VIH
| Afección | Dosis | Vía de administración | Duración |
|---|---|---|---|
| Profilaxis primaria contra la criptococosis | Adultos/Adolescentes: 200 mg una vez al día; Lactantes/Niños: 2-5 mg/kg cada 12-24 horas | Oral | Continua según sea necesario |
| Profilaxis primaria de la histoplasmosis | Adultos/Adolescentes: 200 mg una vez al día; Lactantes/Niños: 2-5 mg/kg cada 12-24 horas | Oral | Continua según sea necesario |
| Profilaxis secundaria de la Coccidioidomicosis | Adultos/Adolescentes: 200 mg dos veces al día; Lactantes/Niños: 2-5 mg/kg cada 12-48 horas | Oral | Generalmente se continúa de por vida |
| Profilaxis secundaria de la histoplasmosis | Adultos/Adolescentes: 200 mg dos veces al día; Lactantes/Niños: 2-5 mg/kg cada 12-48 horas | Oral | En general, de por vida |
| Profilaxis secundaria de la criptococosis | Adultos/Adolescentes: 200 mg una vez al día; Lactantes/Niños: 2-5 mg/kg cada 12-24 horas | Oral | En general, de por vida |
| Profilaxis secundaria de la candidiasis mucocutánea | Adultos/Adolescentes: 200 mg una vez al día; Lactantes/Niños: 5 mg/kg una vez al día | Solución oral | Generalmente se continúa de por vida |
Dosificación en insuficiencia renal y hepática
No parece necesario ajustar la dosis de itraconazol oral en pacientes con insuficiencia renal. El itraconazol inyectable no debe administrarse a pacientes con insuficiencia renal (es decir, con un aclaramiento de creatinina inferior a 30 ml/minuto), ya que la insuficiencia renal grave reduce el aclaramiento de hidroxipropil-b-ciclodextrina (un excipiente del itraconazol inyectable).
Aunque el efecto de la insuficiencia hepática sobre la farmacocinética del itraconazol aún no se ha dilucidado, el fabricante afirma que las concentraciones plasmáticas del medicamento deben controlarse cuidadosamente en pacientes con dicha insuficiencia.
En el Reino Unido, el itraconazol líquido oral está autorizado para su uso en la candidiasis oral y esofágica a una dosis de 200 mg al día durante una semana. Puede tomarse como dosis única diaria o, preferiblemente, en dos dosis divididas, reteniendo el líquido en la boca durante 20 segundos antes de tragarlo. Si no hay respuesta después de una semana, el tratamiento puede continuarse durante otra semana.
En EE.UU. está autorizado un régimen similar para la candidiasis orofaríngea, pero para la candidiasis esofágica se prefiere un régimen alternativo de 100 mg diarios durante al menos tres semanas, aunque la dosis puede aumentarse a 200 mg diarios si es necesario.
Algunas autoridades de EE.UU., como los Centros para el Control y la Prevención de Enfermedades, recomiendan una dosis mayor. El itraconazol también puede administrarse mediante infusión intravenosa a una dosis de 200 mg dos veces al día durante 1 hora durante dos días, y después 200 mg al día.
Dosis altas
En 8 pacientes con micosis sistémicas resistentes al tratamiento convencional se utilizaron dosis de 600 mg diarios de itraconazol en dos tomas divididas durante 3 a 16 meses. Dos pacientes con SIDA y meningitis criptocócica no respondieron, y 2 que respondieron inicialmente recayeron más tarde o desarrollaron una enfermedad progresiva cuando se redujo la dosis. Los principales efectos adversos fueron hipopotasemia, hipertensión y edema, posiblemente asociados a la supresión suprarrenal. En un paciente con aspergilosis cerebral, itraconazol 800 mg diarios durante 5 meses y luego 400 mg diarios durante otros 4 / meses produjo una resolución completa de las lesiones cerebrales.
Administración en niños
| Indicación | Grupo de edad | Dosis | Duración |
|---|---|---|---|
| Tiña de la cabeza | Niños < 20 kg | 50 mg al día por vía oral | Según prescripción |
| Niños ≥ 20 kg | 100 mg al día por vía oral | Según prescripción | |
| Candidiasis orofaríngea | de 1 mes a 12 años | 3 a 5 mg/kg (máx. 100 mg) al día | 15 días |
| 12 a 18 años | 100 mg (200 mg en caso de neutropenia o SIDA) al día | 15 días | |
| Infecciones por dermatofitos | 1 mes a 12 años | 3 a 5 mg/kg diarios (máx. 200 mg para pitiriasis versicolor, máx. 100 mg para tinea corporis, cruris, pedis, manuum) | Varía (7-30 días, según el tipo de infección) |
| de 12 a 18 años | 200 mg al día para la pitiriasis versicolor; 100 mg al día para la tinea corporis y cruris; 100 mg al día o 200 mg dos veces al día para la tinea pedis y manuum | Varía (7-30 días, según el tipo de infección) | |
| Onicomicosis | de 1 a 12 años | Dosis de 5 mg/kg al día para las uñas de las manos (2 dosis) y de los pies (3 dosis) | Repetidos tras intervalos de 21 días |
| de 12 a 18 años | 200 mg al día durante 3 meses o ciclos de 200 mg dos veces al día en uñas de manos (2 ciclos) y pies (3 ciclos) | Repetido a intervalos de 21 días | |
| Histoplasmosis/infecciones fúngicas sistémicas | de 1 mes a 18 años | 5 mg/kg (máx. 200 mg) una o dos veces al día | Según prescripción; dos veces al día en caso de enfermedad invasiva |
| Profilaxis en Neutropenia | 1 mes a 18 años | 5 mg/kg (máx. 200 mg) al día, aumentado a dos veces al día si las concentraciones plasmáticas de itraconazol son bajas | Según prescripción |
| Profilaxis en neoplasias hematológicas | 1 mes a 18 años | 2.5 mg/kg dos veces al día | Comenzar antes del trasplante o la quimioterapia |
| Dosis intravenosas para infecciones sistémicas | 1 mes a 18 años | 2.5 mg/kg (máx. 200 mg) cada 12 horas durante los dos primeros días, después una vez al día durante un máximo de 12 días | Según prescripción |
Consulte la información adicional sobre este medicamento facilitada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Efectos secundarios

Pacientes en España han notificado varios efectos secundarios asociados al uso de Itraconazol. Los trastornos gastrointestinales, como náuseas, diarrea y dolor abdominal, se encuentran entre los más frecuentemente observados. Algunos individuos han experimentado dolores de cabeza y mareos durante el tratamiento. Además, se han observado erupciones cutáneas, que suelen desaparecer al suspender el medicamento.
Los efectos adversos más comunes asociados al itraconazol incluyen dispepsia, dolor abdominal, náuseas, vómitos, estreñimiento, diarrea, dolor de cabeza y mareos. Otros incluyen reacciones alérgicas como prurito, erupción cutánea, urticaria y angioedema. Se han asociado casos aislados de síndrome de Stevens-Johnson con itraconazol. En algunos pacientes se ha producido un aumento de los valores de las enzimas hepáticas y se han observado casos de hepatitis e ictericia colestásica, especialmente en los tratados durante más de un mes.
Se han dado casos raros de insuficiencia hepática y muerte. Raramente se ha notificado insuficiencia cardiaca y edema pulmonar, y se han atribuido acontecimientos cardiovasculares graves, incluyendo arritmias y muerte súbita, a interacciones medicamentosas en pacientes que reciben itraconazol (ver Interacciones más adelante). También se han asociado al uso prolongado alopecia, edema e hipopotasemia.
En unos pocos pacientes se han notificado trastornos menstruales y neuropatía periférica.
Incidencia de efectos adversos
Se consideró que el itraconazol 50 a 400 mg diarios durante una mediana de 5 meses fue bien tolerado en 189 pacientes con infecciones fúngicas sistémicas. De 86 pacientes con enfermedad subyacente, incluidos 49 con SIDA, 16 con diabetes y 23 con neoplasia maligna, se produjeron náuseas y vómitos en 19 pacientes, hipertrigliceridemia en 16, hipopotasemia en 11 y elevación de los valores de las enzimas hepáticas en 13. El papel del itraconazol en la hipertrigliceridemia no pudo evaluarse porque todas las muestras no se tomaron en ayunas, y la hipertrigliceridemia es una complicación de la infección por VIH.
Se produjo ginecomastia en 2 pacientes, 1 de los cuales también tomaba espironolactona.
Se produjeron erupciones cutáneas en 4 pacientes. De 49 pacientes que tomaron itraconazol 100 a 400 mg diarios durante un máximo de 39 meses, 23 no experimentaron efectos adversos durante el tratamiento, mientras que 6 tuvieron náuseas y vómitos, 5 desarrollaron edema y 2 hipertensión 3 de los pacientes que desarrollaron edema y 1 que se volvió hipertenso eran diabéticos. Tres pacientes dejaron de tomar itraconazol, 1 por vómitos, 1 por leucopenia y 1 por síndrome nefrótico. El paciente con síndrome nefrótico tenía edema e hipertensión preexistentes. El síndrome desapareció cuando se suspendió el itraconazol.
Cardiovascular
La fibrilación ventricular se ha atribuido a la hipopotasemia inducida por itraconazol.
En una mujer tratada con 200 mg de itraconazol al día por una infección pulmonar localizada por Aspergillus fumigatus se produjo un derrame pleural y posteriormente pericárdico. Tras más de 9 semanas de tratamiento, desarrolló un derrame pericárdico que precisó drenaje. Se le retiró el itraconazol. Seis semanas más tarde, y 2 semanas después de la reanudación del itraconazol, desarrolló signos de edema pulmonar y agrandamiento cardiaco. Estos signos desaparecieron rápidamente al suspender el itraconazol.
Los estudios en perros y voluntarios humanos sanos han sugerido que el itraconazol tiene un efecto inotrópico negativo; se desconoce el mecanismo. Un análisis sistemático de los datos del Sistema de Notificación de Efectos Adversos (AERS) de la FDA identificó 58 casos sugestivos de insuficiencia cardiaca congestiva en pacientes que tomaban itraconazol. Una búsqueda simultánea no identificó ningún caso de insuficiencia cardiaca congestiva en pacientes que tomaban fluconazol y ketoconazol, descartando la posibilidad de un efecto de clase. En consecuencia, se ha revisado el etiquetado del itraconazol. El itraconazol está ahora contraindicado para el tratamiento de la onicomicosis en pacientes con evidencia de disfunción ventricular.
Para las infecciones fúngicas sistémicas, los riesgos y beneficios de itraconazol deben ser reevaluados si aparecen signos o síntomas de insuficiencia cardíaca congestiva.
Sistema nervioso
En algunos informes se ha mencionado dolor de cabeza debido a itraconazol. Los mareos son una queja infrecuente, al igual que los trastornos del estado de ánimo.
Psicológicos, psiquiátricos
Se han descrito alucinaciones visuales con confusión en una mujer de 75 años, que ocurrieron en tres ocasiones distintas, cada vez unas 2 horas después de una dosis de 200 mg de itraconazol. Sus síntomas remitieron espontáneamente en unas 8 horas.
Equilibrio electrolítico
La hipopotasemia, que se produce de forma aislada o con hipertensión, se ha notificado regularmente en una pequeña fracción de pacientes. Se observó un marcado edema de tobillo con aumento de peso en un paciente que tomaba itraconazol 400 mg/día, para el que no había más explicación que el uso del fármaco; tras la retirada del itraconazol, los síntomas desaparecieron. También se han observado hipopotasemia y edema en varios pacientes que tomaban un tratamiento a dosis altas (600 mg/día), asociados a concentraciones de aldosterona ligeramente deprimidas.
Gastrointestinal
En pacientes que toman itraconazol pueden aparecer dispepsia, pirosis, náuseas, vómitos, molestias epigástricas leves y diarrea. Estas molestias gastrointestinales son generalmente leves, pero parecen ser los efectos adversos más frecuentes durante el tratamiento. La incidencia total de efectos adversos fue del 3-5% en pacientes tratados por micosis superficial y del 8% en 99 pacientes tratados por micosis profunda. Un ensayo multicéntrico informó de una incidencia cercana al 15%.
En 50 mujeres con candidiasis vaginal aguda, se notificaron efectos adversos en 17 (35%), náuseas en siete, cefalea en seis, mareos en tres y distensión abdominal en tres, mientras que la actividad de la transaminasa de aspartato se elevó en una.
De 1108 pacientes con VIH tratados por candidiasis mucosa, 239 declararon síntomas gastrointestinales.
Se ha notificado colitis pseudomembranosa asociada a la exposición al itraconazol.
Un hombre de 54 años desarrolló un nuevo dolor abdominal y diarrea no sanguinolenta 1 mes después de la exposición a un ciclo de 7 días de itraconazol oral 200 mg/día. Tomaba sertralina crónica estable, ácido valproico y perfenazina y no había tomado fármacos antimicrobianos durante 6 meses. La sigmoidoscopia flexible tras la evolución clínica mostró pseudomembranas, y la evaluación posterior excluyó otras causas de diarrea. Aunque el cultivo de Clostridium difficile y el ensayo de toxinas fueron finalmente negativos, posiblemente debido al retraso en la toma de muestras de heces, el paciente respondió a un tratamiento de 10 días con fármacos antianaeróbicos y fue dado de alta con síntomas completamente resueltos.
Los autores propusieron que el itraconazol había alterado la flora fúngica residente del colon.
Hígado
En la mayoría de los informes clínicos, hubo algunos casos de aumento de la actividad de las enzimas hepáticas; los cambios fueron transitorios o desaparecieron tras la retirada del itraconazol. No se notificó hepatotoxicidad más grave.
Se ha notificado hiperplasia nodular focal del hígado en una mujer de 38 años que había tomado itraconazol 200 mg/día durante 4 meses para una infección fúngica de las uñas. No había tomado ningún otro fármaco durante el año en el que se desarrolló la hiperplasia nodular focal.
De tres pacientes, dos mujeres de 62 y 57 años y un hombre de 75 años, que desarrollaron lesión hepática sintomática 5-6 semanas después de empezar a tomar itraconazol, dos tenían el patrón bioquímico de lesión hepática colestásica.
Se han analizado todos los ensayos clínicos con itraconazol patrocinados por la Janssen Research Foundation para el tratamiento de la onicomicosis, en los que hubo una evaluación de la seguridad en el laboratorio. No hubo diferencias significativas en el número de anomalías de código 4 (el valor basal está en el intervalo de referencia y al menos dos valores, o la última prueba en el periodo de observación, superan dos veces el límite superior del intervalo de referencia) en las pruebas de función hepática (alanina transaminasa, aspartato transaminasa, fosfatasa alcalina y bilirrubina total). La incidencia de todas las anomalías del código 4 fue inferior al 2%. La terapia de pulso con itraconazol para la onicomicosis parece ser segura, especialmente desde la perspectiva del daño hepático potencial. En el prospecto del itraconazol, se recomienda realizar pruebas de la función hepática a los pacientes que reciban itraconazol de forma continuada durante más de 1 mes. No existe tal requisito de monitorización para el régimen de pulso, a menos que el paciente tenga antecedentes de enfermedad hepática subyacente, las pruebas de función hepática sean anormales al inicio, o aparezcan signos o síntomas sugestivos de disfunción hepática en cualquier momento.

Piel
Los pacientes que toman itraconazol han notificado diferentes tipos de erupción cutánea, incluyendo erupción acneiforme. En un caso, se observaron bullas sanguinolentas.
Un hombre de 29 años desarrolló una erupción maculopapular infiltrante tras 1 semana de tratamiento con itraconazol 100 mg al día para la tinea corporis. Se retiró el itraconazol y las lesiones desaparecieron en 7 días. Las pruebas de rascado, las pruebas de parche, las pruebas de rascado-parche y las pruebas de estimulación linfocitaria inducida por fármacos para itraconazol fueron negativas; sin embargo, una nueva provocación con itraconazol sistémico indujo una erupción maculopapular en la cara, las manos y la parte dorsal de los pies. Las cápsulas vacías de itraconazol no tuvieron efectos cutáneos, lo que sugiere una reacción alérgica a un metabolito del compuesto.
Se ha atribuido fotosensibilidad al itraconazol (200 mg al día durante 5 días), con una dosis mínima de eritema reducida tanto para UVB (0,12 J/cm) como para UVA (20,1 J/cm), una prueba de fotoparche negativa y una fotoexposición positiva. Los autores propusieron un mecanismo fotoalérgico porque la exposición previa al itraconazol no había tenido incidencias. Sin embargo, no se dieron detalles sobre la exposición al sol durante la primera exposición ni sobre la intensidad de la exposición al sol durante el procedimiento de fotoexposición oral. La erupción respondió a los esteroides orales, lo que es más típico de las reacciones fotoalérgicas que de las fototóxicas.
Se ha estimado el riesgo de trastornos cutáneos graves en 61 858 usuarios de antifúngicos orales, de entre 20 y 79 años de edad, identificados en la Base de Datos de Investigación de Práctica General del Reino Unido. Habían recibido al menos una receta de fluconazol, griseofulvina, itraconazol, ketoconazol o terbinafina orales. La tasa de fondo de reacciones adversas cutáneas graves (correspondiente a la no utilización de antifúngicos orales) fue de 3,9 por 10 000 personas-año (IC 95% = 2,9). Las tasas de incidencia para el uso actual fueron de 15 por 10 000 personas-año (1 para el itraconazol, 11,1 (3 para la terbinafina, 10 (1 para el fluconazol y 4,6 (0 para la griseofulvina. Los trastornos cutáneos asociados al uso de antifúngicos orales en este estudio fueron todos leves.
Función sexual
Existen informes contradictorios sobre los efectos del itraconazol en los esteroides sexuales. Las concentraciones de testosterona, corticosterona y progesterona permanecieron inalteradas en ratas y seis perros en los que se estudiaron los posibles efectos endocrinos. Por otra parte, la administración de itraconazol a siete voluntarios varones durante dos semanas no produjo cambios detectables en las concentraciones plasmáticas de testosterona o cortisol. Dos semanas después del inicio del tratamiento con dosis altas de itraconazol (600 mg/día), uno de ocho pacientes con micosis grave mostró una respuesta ligeramente reducida del cortisol a la estimulación con ACTH.
Se ha descrito impotencia eréctil, con concentraciones normales de esteroides, así como una reducción de la libido.
Inmunológico
Itraconazol 200 mg al día durante 2 semanas causó una reacción similar a la enfermedad del suero en una mujer de 53 años con enfermedad de Meniere.
La mayoría de los efectos adversos comunicados del itraconazol son transitorios. No son infrecuentes las reacciones gastrointestinales, dispepsia leve, pirosis, náuseas, vómitos, diarrea y dolor epigástrico. En muchos de los informes publicados se mencionan aumentos de la actividad sérica de las enzimas hepáticas e hipertrigliceridemia, y se ha notificado toxicidad hepática sintomática. El itraconazol no induce enzimas de metabolización de fármacos y es un inhibidor más débil de las enzimas microsomales que el ketoconazol. En ratas a las que se administraron dosis de hasta 160 mg/kg, no se produjo inducción ni inhibición del metabolismo de xenobióticos.
A menudo se ha informado de hipopotasemia sin una explicación del mecanismo. Dosis superiores (400 o incluso 600 mg/día) provocan una mayor incidencia de efectos adversos; entre los documentados a estas dosis se encuentran hipopotasemia grave, insuficiencia suprarrenal reversible y (en un caso publicado) arritmias, estas últimas relacionadas con una interacción con la terfenadina. Se han notificado erupciones cutáneas y prurito. No se han descrito efectos tumorales.
Los efectos adversos más frecuentes en pacientes que tomaron cápsulas de itraconazol durante periodos prolongados fueron náuseas y vómitos (menos del 10%), hipertrigliceridemia (9%), hipopotasemia (6%), aumento de las transaminasas (5%), erupciones cutáneas y/o prurito (2%), cefalea o mareos (menos del 2%) y edema en los pies (1%).
En un estudio en el que se utilizó la Base de Datos de Investigación de la Práctica General del Reino Unido para determinar las tasas de efectos adversos graves, poco frecuentes, inducidos por medicamentos en el hígado, los riñones, la piel o la sangre, que se produjeron en los 45 días siguientes a la finalización de una prescripción o renovación en 54 803 usuarios de fluconazol o itraconazol, un paciente tuvo una prueba de función hepática anormal mientras tomaba itraconazol en el que no se pudo descartar una etiología inducida por el medicamento, una tasa de 3,2 por 100 000 prescripciones (IC del 95% para efectos adversos hepáticos graves. Por lo tanto, el itraconazol no suele tener efectos adversos graves en el hígado, los riñones, la piel o la sangre.
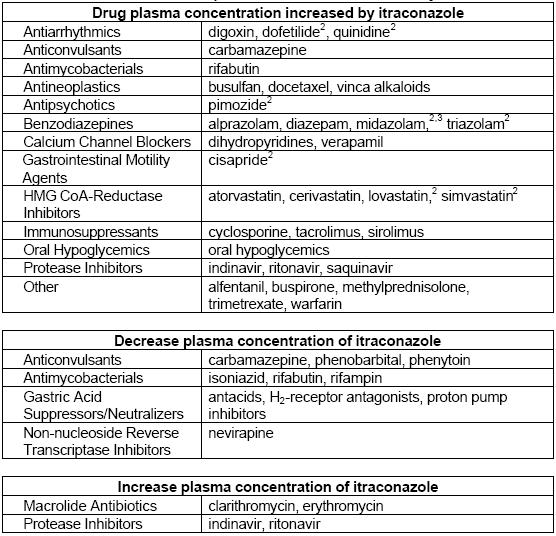
Interacciones
| Categoría | Medicamento | Interacción con Itraconazol | Efectos |
|---|---|---|---|
| Estatinas | Atorvastatina | Aumento de las concentraciones séricas debido a la inhibición de CYP3A4. | AUC aumentado en un 150%, Cmax aumentada en un 38%, semivida prolongada en un 30%. |
| Cerivastatina | Aumento moderado de las concentraciones séricas; vía secundaria CYP2C8 no afectada por itraconazol. | Pequeños aumentos del AUC, la Cmáx y la semivida (hasta 51%, 25% y 23% respectivamente). | |
| Fluvastatina | Sin efecto significativo sobre la Cmáx o el AUC; ligera prolongación de la semivida. | Interacción mínima; se considera seguro con itraconazol. | |
| Lovastatina | Gran aumento de las concentraciones plasmáticas incluso a dosis bajas de itraconazol. | La Cmáx aumentó ~15 veces, el AUC total aumentó >15 veces; se recomienda precaución. | |
| Pravastatina | Ligeros aumentos del AUC y la Cmáx; cambios no estadísticamente significativos. | La semivida permanece inalterada; interacción mínima observada. | |
| Simvastatina | Aumento marcado de la exposición sistémica cuando se combina con itraconazol. | La Cmáx y el AUC aumentaron al menos 10 veces; en algunos casos se observó un riesgo significativo de rabdomiólisis. | |
| Glucocorticoides | Budesonida | Aumento de la inhibición del aclaramiento metabólico que provoca insuficiencia suprarrenal en algunos pacientes. | El AUC se multiplicó por 4,2, la semivida se prolongó de 1,6 a 6,2 horas; se observó una supresión significativa del cortisol. |
| Dexametasona | Exposición y efectos sistémicos notablemente aumentados debido a la reducción del aclaramiento por itraconazol. | El AUC aumentó casi cuatro veces, la semivida se prolongó más de tres veces; se observaron niveles más bajos de cortisol. | |
| Metilprednisolona | Aumento significativo de la exposición debido a la inhibición del CYP3A4 por itraconazol. | El AUC aumentó 3,9 veces, la semivida se prolongó de 2,1 a 4,8 horas; se observó una mayor supresión suprarrenal. | |
| Prednisolona | Interacción menor con significación clínica limitada en comparación con la metilprednisolona. | AUC aumentado en un 24%, semivida prolongada en un 29%; generalmente seguro de usar con itraconazol. |
Otras interacciones
Tacrolimus
Las concentraciones y la toxicidad del tacrolimus se ven afectadas por el itraconazol.
- En un varón de 17 años con fibrosis quística que recibió un trasplante hepato-pulmonar, se produjo una interacción de itraconazol 600 mg al día con tacrolimus. Se observaron altas concentraciones mínimas de tacrolimus, a pesar de la dosis relativamente baja (0,1-0,3 mg/kg/día).
- Otro paciente experimentó una interacción de tacrolimus 0,085 mg/kg/día con itraconazol 200-400 mg/día, con la consiguiente cetoacidosis, neutropenia y trombocitopenia, lo que obligó a retirar ambos fármacos.
- Un hombre de 30 años con un trasplante renal presentó un aumento de más del doble en las concentraciones de tacrolimus en sangre tras empezar a tomar itraconazol 200 mg/día, acompañado de una tasa de filtración glomerular reducida y una tubulopatía asociada a tacrolimus probada mediante biopsia.
Dado que el tacrolimus tiene un índice terapéutico estrecho, las concentraciones sanguíneas deben controlarse con especial atención cuando se coadministra itraconazol, y puede ser necesario modificar la dosis de tacrolimus.
Se ha estudiado la interacción de itraconazol (100 mg db) con tacrolimus en 28 receptores de trasplante de corazón o pulmón. Se monitorizaron las concentraciones sanguíneas de tacrolimus en días alternos durante un máximo de 21 días tras el inicio del tratamiento con itraconazol o su retirada. La dosis de tacrolimus se ajustó para mantener la concentración sanguínea mínima en 12 horas entre 7 y 12 microgramos/ml.
La dosis media de tacrolimus durante el tratamiento con itraconazol disminuyó significativamente de 8,4 a 2,9 mg/día. No se produjeron cambios significativos en la creatinina sérica ni en las pruebas de función hepática. En los pacientes en los que se retiró el itraconazol, la dosis media de tacrolimus requerida aumentó significativamente de 4,7 a 8,8 mg/día. Así pues, se requirieron cambios sustanciales en la dosis de tacrolimus tanto cuando se inició el itraconazol como cuando se retiró, y fue difícil mantener las concentraciones sanguíneas de tacrolimus dentro del intervalo objetivo durante las 2 primeras semanas. Sin embargo, no se produjeron toxicidades importantes ni rechazos.
La administración conjunta de itraconazol puede reducir el coste de la inmunosupresión postrasplante. Esta interacción se debe probablemente a la inhibición del CYP3A4 por el itraconazol.
Alcaloides de la vinca
La neurotoxicidad potenciada y potencialmente mortal de los alcaloides de la vinca por el tratamiento concomitante con itraconazol ha sido objeto de varios informes convincentes. La potenciación de la neurotoxicidad de la vincristina provoca polineuropatía e íleo paralítico. La interacción es reversible, y la lectura-tracción de los alcaloides de la vinca puede ser segura tras un lavado prolongado. El mecanismo no se ha dilucidado formalmente, pero puede ser o bien la competencia por el metabolismo oxidativo, que conduce a un aumento de la exposición sistémica, o bien la inhibición de la bomba de eflujo de la glicoproteína P transmembrana, que conduce a un aumento de las concentraciones intracelulares de alcaloides de la vinca. Por lo tanto, está contraindicado el uso concomitante de itraconazol y alcaloides de la vinca.
Dos adultos con leucemia linfoblástica aguda desarrollaron una neurotoxicidad inusualmente grave causada por la vincristina, que probablemente fue el resultado de una interacción con la suspensión de itraconazol.
Warfarina
El itraconazol puede alterar las concentraciones de warfarina.
Tras la adición de itraconazol a un régimen de tratamiento que comprendía warfarina, ranitidina y terfenadina, se desarrollaron disritmias cardiacas en un hombre de 62 años. Los signos y síntomas incluían prolongación del intervalo QT y fibrilación ventricular.
Al parecer, este régimen concreto dio lugar a una segunda interacción, ya que se encontraron concentraciones inesperadamente elevadas de terfenadina. Otros han descrito este fenómeno, que implica un marcado aumento de las concentraciones séricas de terfenadina y una mayor toxicidad del fármaco durante la ingestión simultánea de itraconazol. Se desconoce el mecanismo, pero es probable que esté relacionado con la inhibición del CYP3A4.
Zolpidem
El zolpidem es transformado principalmente por el CYP3A4. Sin embargo, itraconazol 200 mg no alteró la farmacocinética ni la farmacodinámica de zolpidem 10 mg en 10 voluntarios sanos. Por lo tanto, zolpidem puede utilizarse en dosis normales o casi normales junto con itraconazol.
Anfotericina
Se utilizaron seis cepas de A. fumigates para probar los efectos in vitro de la combinación de anfotericina con itraconazol. Tras el pretratamiento, se observó un efecto antagonista para todas las cepas in vitro y para una cepa en un modelo de ratón de aspergilosis.
El efecto de la combinación de itraconazol con anfotericina sobre las actividades de las enzimas hepáticas se ha estudiado retrospectivamente en 20 pacientes con neoplasias hematológicas o enfermedad pulmonar crónica complicada por infección o colonización fúngica. Tomaron itraconazol 200-600 mg/día durante una mediana de 143 (intervalo de 44 días. Nueve no tenían pruebas de función hepática anormales, incluidos periodos de altas concentraciones de itraconazol (más de 5000 µg/ml) y su metabolito hidroxilado activo; sólo uno había recibido anfotericina concomitante. Los 11 pacientes con anomalías de la función hepática habían recibido anfotericina concomitante.
Para cada paciente, las anomalías de la función hepática fueron mayores durante el tratamiento concomitante con ambos antifúngicos. Aunque las anomalías de las enzimas hepáticas son infrecuentes con la anfotericina, y aunque este análisis retrospectivo estaba sujeto a varios defectos y sesgos potenciales, sugiere no obstante que la hepatotoxicidad debe vigilarse cuidadosamente si se coadministran itraconazol y anfotericina.
Antihistamínicos
Parece probable que la combinación de itraconazol con astemizol y terfenadina provoque un aumento de los efectos de estos antihistamínicos.
Barbitúricos
Los barbitúricos disminuyen las concentraciones de itraconazol.
Benzodiazepinas
El efecto del itraconazol sobre la farmacocinética y la farmacodinámica de una dosis oral única de estazolam se ha estudiado en un estudio doble ciego, aleatorizado y cruzado en 10 voluntarios varones sanos, que tomaron itraconazol oral 100 mg/día o placebo durante 7 días y el día 4 una dosis oral única de estazolam 4 mg. Se tomaron muestras de sangre y se evaluó la función psicomotora mediante el Test de Sustitución de Símbolos Digitales, la Escala Visual Analógica y la Escala de Somnolencia de Stanford hasta 72 horas después del estazolam. No hubo diferencias significativas entre las fases de placebo e itraconazol en la concentración plasmática máxima, el aclaramiento y la semivida. Del mismo modo, la función psicomotora no se vio afectada. Estos resultados sugieren que el CYP3A4 no interviene en gran medida en el metabolismo del estazolam.
En un estudio de los efectos de itraconazol 200 mg/día y rifampicina 600 mg/día sobre la farmacocinética y farmacodinámica de midazolam oral 7,5-15 mg durante y 4 días después de finalizar el tratamiento, el cambio de inhibición a inducción del metabolismo provocó un cambio de hasta 400 veces en el AUC de midazolam oral.
Bupivacaína
La interacción de 200 mg de itraconazol por vía oral durante 4 días con una dosis intravenosa única de bupivacaína racémica (0,3 mg /kg administrada durante 60 minutos) se ha examinado en un estudio cruzado controlado con placebo en 10 voluntarios sanos. El itraconazol redujo el aclaramiento de la R-bupivacaína en un 21% y el de la 5-bupivacaína en un 25%, pero no tuvo otros efectos significativos sobre la farmacocinética de los enantiómeros. Es probable que la reducción del aclaramiento de bupivacaína por itraconazol aumente las concentraciones en estado estacionario de los enantiómeros de bupivacaína en un 20-25%, y esto debe tenerse en cuenta en el uso concomitante de itraconazol y bupivacaína.
Buspirona
Se ha estudiado la interacción del itraconazol con el metabolito activo l-(2-pirimidinil)-piperazina de la buspirona tras una dosis oral única de 10 mg de buspirona. El itraconazol redujo el AUC medio del metabolito en un 50% y la Cmáx en un 57%, mientras que el AUC medio y la Cmáx del fármaco original se multiplicaron por 14,5 y por 10,5, respectivamente. Así pues, el itraconazol provocó cambios relativamente menores en las concentraciones plasmáticas del metabolito piperazínico activo de la buspirona, aunque tuvo efectos importantes sobre las concentraciones de buspirona tras una dosis oral única.
Busulfán
Se ha informado de una reducción de la eliminación y un aumento de la toxicidad del busulfán coadministrado con itraconazol.
Carbamazepina
Se han observado concentraciones séricas bajas y a veces muy bajas de itraconazol durante la terapia concurrente de itraconazol con carbamazepina.
Ciclosporina
La combinación de itraconazol con ciclosporina conduce a un marcado aumento de las concentraciones de ciclosporina en sangre, lo que puede elevar la creatinina sérica. Esto apunta claramente a un daño renal causado por las altas concentraciones de ciclosporina. Sin embargo, no se ha demostrado una interacción en todos los casos.
Se han notificado dos casos de rabdomiólisis causada por itraconazol en receptores de trasplante cardíaco que tomaban ciclosporina y simvastatina a largo plazo. Para evitar una miopatía grave, deben controlarse con frecuencia las concentraciones de ciclosporina, y deben retirarse las estatinas, o reducirse la dosis, siempre que sea necesario prescribir azoles en receptores de trasplantes. Es necesario educar a los pacientes sobre los signos y síntomas que requieren la intervención inmediata del médico.
Tampón citrato-fosfato
El tampón citrato-fosfato utilizado para facilitar la absorción de la dideoxinosina (didanosina), prescrita para el tratamiento del SIDA, puede interferir en la absorción del itraconazol.
Claritromicina
Un informe de tres pacientes seronegativos ha sugerido que el tratamiento concomitante con itraconazol y claritromicina puede dar lugar a un aumento de la exposición a la claritromicina, con una mayor relación metabólica, posiblemente relacionada con el efecto del itraconazol sobre el CYP3A4. No obstante, en ninguno de los tres individuos notificados se observaron efectos adversos derivados de esta presunta interacción.
Clozapina
Itraconazol 200 mg no tuvo ningún efecto significativo sobre las concentraciones séricas de clozapina 200-550 mg/día o desmetilclozapina en 7 pacientes esquizofrénicos.
Digoxina
El itraconazol inhibe la eliminación de la digoxina, lo que puede provocar toxicidad.
El itraconazol aumenta el AUC0_72 de la digoxina en aproximadamente un 50% y reduce su aclaramiento renal en aproximadamente un 20%. Aparte de la inhibición de la secreción renal de digoxina, probablemente mediada por la inhibición de la glucoproteína P, un estudio realizado en cobayas también mostró una reducción significativa de la excreción biliar de digoxina por itraconazol, lo que sugiere que la interacción entre itraconazol y digoxina puede deberse no sólo a una reducción del aclaramiento renal, sino también a una reducción del aclaramiento metabólico de digoxina por itraconazol.
La importancia de esta interacción ha sido subrayada por un informe de dos pacientes con trasplante renal que presentaron toxicidad por digoxina cuando tomaron itraconazol simultáneamente.
Famotidina
Famotidina 40 mg/kg/día redujo las concentraciones máximas y mínimas de itraconazol 200 mg/kg/día en aproximadamente un 35% en 18 pacientes sometidos a quimioterapia por neoplasias hematológicas.
Fentanilo
El fentanilo es un sustrato de CYP3A4, CYP2C9 y CYP2C19. Sin embargo, en un estudio, la farmacocinética y la farmacodinámica de fentanilo 3 microgramos/kg fueron similares después de itraconazol 200 mg y placebo en 10 voluntarios sanos.
Se ha notificado una interacción de itraconazol con fentanilo en un hombre de 67 años con cáncer que tomaba una dosis estable de fentanilo transdérmico de 50 microgramos/hora. Tomó itraconazol 200 mg al día para la candidiasis orofaríngea y, 24 horas después, desarrolló signos de toxicidad opiácea, que se revirtieron al retirar el fentanilo y sustituirlo por opiáceos de acción corta.
Puede tratarse de una interacción a la que sólo algunos individuos son susceptibles.
Flucitosina
La combinación de itraconazol con flucitosina puede potenciar su actividad contra los hongos negros; esta combinación ha evitado el desarrollo de resistencia a la flucitosina.
Información importante sobre seguridad
Edad
La seguridad, tolerabilidad y farmacocinética de itraconazol y su metabolito activo hidroxitraconazol tras la administración de itraconazol en solución en hidroxipropil-P-ciclodextrina se han investigado en un estudio multicéntrico en 26 lactantes y niños de 6 meses a 12 años con candidiasis mucosa o en riesgo de enfermedad fúngica invasiva. Se observó una tendencia a concentraciones plasmáticas mínimas más bajas en niños de 6 meses a 2 años. La absorción sistémica del solubilizante hidroxipropil-P-ciclodextrina fue inferior al 1%. Administrada a 5 mg/kg/día, esta formulación proporcionó concentraciones potencialmente terapéuticas en plasma, algo inferiores a las alcanzadas en adultos, y fue bien tolerada y segura.
El itraconazol 100 mg/día se ha estudiado en 24 niños con tinea capitis por Trichophyton tonsurans. El itraconazol fue bien tolerado, pero 15 niños requirieron un nuevo tratamiento debido a la persistencia de la infección.
La seguridad, farmacocinética y farmacodinámica de una suspensión oral de itraconazol ciclodextrina (2,5 mg /kg od o bd durante 15 días) se han investigado en un estudio abierto, secuencial, de escalada de dosis en 26 niños y adolescentes, de 5 a 18 años de edad, infectados por el VIH (recuento medio de CD4 128 x 106/1) con candidiasis orofaríngea. Aparte de alteraciones gastrointestinales de leves a moderadas en tres pacientes, itraconazol ciclodextrina fue bien tolerado.
Dos pacientes se retiraron prematuramente debido a acontecimientos adversos. La puntuación de la candidiasis orofaríngea descendió significativamente de una media de 7,46 al inicio a 2,8 al final del tratamiento, lo que demuestra la eficacia antifúngica en este contexto. Basándose en estos resultados, se recomendó una dosis de 2,5 mg/kg/día para el tratamiento de la candidiasis orofaríngea en niños a partir de 5 años.
La seguridad y eficacia del itraconazol ciclodextrina oral (5 mg/kg/día) como profilaxis antifúngica se ha evaluado en un ensayo abierto en 103 niños neutropénicos (mediana de edad 5 años; intervalo 0-15 años). La profilaxis se inició al menos 7 días antes del inicio de la neutropenia y continuó hasta la recuperación de los neutrófilos. De los 103 pacientes, sólo 47 completaron el ciclo de profilaxis; 27 se retiraron por mal cumplimiento, 19 por acontecimientos adversos y 10 por otros motivos. En 21 pacientes se produjeron acontecimientos adversos graves (distintos de la muerte), como convulsiones, sospecha de interacciones farmacológicas, dolor abdominal y estreñimiento. Los acontecimientos adversos más frecuentes que se consideraron definitivamente o posiblemente relacionados con el itraconazol fueron vómitos, función hepática anormal y dolor abdominal.
La tolerabilidad de la medicación del estudio en el punto final se calificó de buena (55%), moderada (11%), mala (17%) o inaceptable (17%). No hubo problemas inesperados de seguridad o tolerabilidad.
Embarazo, fertilidad y lactancia
Aunque hasta la fecha no existen estudios adecuados y controlados en humanos, itraconazol ha demostrado ser teratogénico y embriotóxico en animales. Por lo tanto, itraconazol debe utilizarse durante el embarazo sólo cuando los beneficios potenciales justifiquen los posibles riesgos para el feto.
Para el tratamiento de la onicomicosis, el uso de itraconazol está contraindicado en mujeres embarazadas y también está contraindicado en mujeres que contemplan un embarazo.
Si se inicia la terapia con itraconazol para el tratamiento de la onicomicosis en una mujer en edad fértil, la primera dosis del fármaco debe administrarse el segundo o tercer día del siguiente período menstrual normal, y deben tomarse medidas para asegurar que se continúe con una anticoncepción eficaz durante toda la terapia con itraconazol y durante 2 meses adicionales tras la interrupción del fármaco. En estudios de reproducción, itraconazol causó un aumento relacionado con la dosis de toxicidad materna, embriotoxicidad y teratogenicidad en ratas a dosis de aproximadamente 40-160 mg/kg diarios (5-20 veces la dosis máxima recomendada en humanos) y en ratones a dosis de aproximadamente 80 mg/kg diarios (10 veces la dosis máxima recomendada en humanos).
La teratogenicidad consistió en defectos esqueléticos importantes en ratas y encefaloceles y/o macroglosia en ratones.
Aunque se observó toxicidad parental, los estudios de reproducción en ratas macho y hembra que recibieron dosis orales de itraconazol de hasta 40 mg/kg diarios (5 veces la dosis humana máxima recomendada) no revelaron evidencias de alteraciones de la fertilidad. Se produjo una toxicidad parental más grave, incluyendo la muerte, con una dosis de 160 mg/kg diarios (20 veces la dosis máxima recomendada para humanos).
El itraconazol se distribuye en la leche humana, y los beneficios esperados del itraconazol para la mujer lactante deben sopesarse frente al riesgo potencial para el lactante por la exposición al medicamento. Debido al potencial de transmisión del VIH a un niño no infectado, los Centros para el Control y la Prevención de Enfermedades (CDC) de EE.UU. recomiendan actualmente que las mujeres infectadas por el VIH no amamanten a sus hijos.
Precauciones relacionadas con los efectos cardiovasculares
Se han notificado casos de insuficiencia cardiaca congestiva, edema periférico y edema pulmonar en pacientes inmunodeprimidos o inmunocompetentes que recibieron itraconazol IV u oral para tratar infecciones fúngicas sistémicas y en pacientes inmunocompetentes que recibieron itraconazol oral en cápsulas para tratar la onicomicosis. Las cápsulas de itraconazol no deben utilizarse para tratar la onicomicosis en pacientes con evidencia de disfunción ventricular, como insuficiencia cardiaca congestiva, o con antecedentes de insuficiencia cardiaca congestiva.
Para otras indicaciones (por ejemplo, el tratamiento de infecciones fúngicas sistémicas) en pacientes con evidencia de disfunción ventricular, el itraconazol IV u oral debe utilizarse sólo cuando los beneficios superen claramente los riesgos.
Los clínicos deben revisar cuidadosamente los riesgos y beneficios del tratamiento con itraconazol en pacientes con factores de riesgo de insuficiencia cardiaca congestiva (por ejemplo, aquellos con enfermedades cardiacas como enfermedad isquémica y valvular, enfermedad pulmonar clínicamente importante como enfermedad pulmonar obstructiva crónica, o insuficiencia renal y otros trastornos edematosos), y el itraconazol IV y la solución oral de itraconazol deben utilizarse con precaución en estos pacientes.
Si se considera necesario el uso de itraconazol en pacientes con factores de riesgo de insuficiencia cardiaca congestiva, se les debe informar de los signos y síntomas de la insuficiencia cardiaca congestiva y se les debe monitorizar cuidadosamente durante el tratamiento. Los pacientes que desarrollen insuficiencia cardiaca congestiva mientras reciben itraconazol cápsulas orales deben suspender el medicamento. Si la insuficiencia cardíaca congestiva ocurre durante la terapia con itraconazol IV o itraconazol solución oral, el paciente debe ser monitoreado cuidadosamente, y las opciones terapéuticas (incluyendo la posible interrupción de la droga) deben ser evaluadas.
Debido a que el itraconazol y su metabolito principal, el hidroxitraconazol, son potentes inhibidores del sistema isoenzimático del citocromo P-450 (CYP) 3A4, el uso concomitante del agente antifúngico con fármacos metabolizados por estas enzimas puede aumentar las concentraciones plasmáticas de estos fármacos dando lugar a aumentos potenciales de sus efectos terapéuticos y adversos. Se han notificado efectos adversos cardiovasculares graves (prolongación del intervalo QT, torsades de pointes, taquicardia ventricular, parada cardiaca y/o muerte súbita) en pacientes que reciben itraconazol concomitantemente con ciertos fármacos metabolizados por las enzimas CYP3A4 (p. ej., cisaprida, dofetilida, pimozida, quinidina), por lo que está contraindicado el uso concomitante con estos fármacos.
Precauciones relacionadas con los efectos hepáticos
Debido a que se han notificado raros casos de hepatotoxicidad grave con itraconazol, incluyendo algunos casos en la primera semana de tratamiento, la terapia con itraconazol no debe utilizarse en pacientes con aumento de las enzimas hepáticas séricas, enfermedad hepática activa o antecedentes de toxicidad hepática con otros fármacos, a menos que los beneficios potenciales superen los riesgos. Las concentraciones séricas de enzimas hepáticas deben controlarse en cualquier paciente con anomalías preexistentes de la función hepática y en aquellos que hayan experimentado toxicidad hepática con otros fármacos.
Además, debe considerarse la monitorización de las enzimas hepáticas séricas en todos los pacientes que reciban itraconazol, especialmente en aquellos que reciban tratamiento con itraconazol de forma continuada durante más de 1 mes. El itraconazol debe suspenderse inmediatamente y deben realizarse pruebas de la función hepática si durante el tratamiento aparecen signos y síntomas compatibles con enfermedad hepática. Los riesgos y beneficios de itraconazol deben ser reevaluados en estos pacientes. Debe indicarse a los pacientes que interrumpan inmediatamente el tratamiento con itraconazol y que se pongan en contacto con su médico si aparecen signos o síntomas de disfunción hepática, como fatiga inusual, orina oscura, heces pálidas, anorexia, náuseas, vómitos o ictericia, para que puedan realizarse las pruebas de laboratorio adecuadas.
Otras precauciones y contraindicaciones
Si se produce una neuropatía que pueda ser atribuible al itraconazol, debe suspenderse el medicamento. Debido a que el itraconazol puede causar hipopotasemia, algunos clínicos recomiendan monitorizar las concentraciones séricas de potasio en pacientes que reciben dosis relativamente altas y/o terapia prolongada con el fármaco. El itraconazol está contraindicado en pacientes con hipersensibilidad conocida al fármaco o a cualquier ingrediente de la formulación.
Aunque no se dispone de información relativa a la sensibilidad cruzada entre el itraconazol y otros agentes antifúngicos triazoles o imidazoles, el fabricante afirma que el itraconazol debe utilizarse con precaución en individuos hipersensibles a otros azoles.
Precauciones pediátricas
No se ha establecido la seguridad y eficacia de itraconazol en niños menores de 18 años. Un número limitado de pacientes de 3 a 16 años con infecciones fúngicas sistémicas no meníngeas han recibido cápsulas de itraconazol a una dosis de 100 mg diarios sin efectos adversos inusuales. Además, un número limitado de pacientes pediátricos de 6 meses a 12 años han recibido itraconazol solución oral a una dosis de 5 mg/kg una vez al día durante 2 semanas sin efectos adversos inusuales.
Sin embargo, los datos de estudios en animales han demostrado que el itraconazol induce defectos óseos en ratas que recibieron dosis tan bajas como 20 mg/kg diarios (2. veces la dosis máxima recomendada en humanos). Los defectos incluían una disminución de la actividad de la placa ósea, un adelgazamiento de la zona compacta de los huesos grandes y un aumento de la fragilidad ósea. A una dosis de 80 mg/kg diarios (10 veces la dosis máxima recomendada en humanos) durante más de 1 año o 160 mg/kg diarios (20 veces la dosis máxima recomendada en humanos), el fármaco indujo pulpa dental pequeña con aspecto hipocelular en algunas ratas.
Aunque la toxicidad ósea observada en animales no se ha comunicado hasta la fecha en pacientes adultos que reciban el medicamento, se desconoce el efecto a largo plazo del tratamiento con itraconazol en niños.
Precauciones geriátricas
Los estudios clínicos de itraconazol IV no incluyeron un número suficiente de pacientes de 65 años o más para determinar si los pacientes geriátricos responden de forma diferente a los pacientes más jóvenes. Aunque otras experiencias clínicas no han revelado diferencias en la respuesta, la dosificación del fármaco debe seleccionarse con precaución en pacientes geriátricos. También debe tenerse en cuenta la mayor frecuencia de disminución de la función hepática, renal y/o cardiaca y de enfermedades concomitantes y terapia farmacológica observada en los ancianos.
Mutagenicidad y carcinogenicidad
No hubo evidencia de mutagenicidad cuando se ensayó itraconazol en sistemas de prueba bacterianos, de mamíferos y no mamíferos inapropiados. No hubo indicios de carcinogenicidad en ratones que recibieron itraconazol por vía oral durante 23 meses a dosis de hasta 80 mg/kg diarios (unas 10 veces la dosis máxima recomendada en humanos). Hubo un ligero aumento de la incidencia de sarcoma de tejidos blandos en ratas macho que recibieron 25 mg/kg diarios (3,1 veces la dosis máxima recomendada para humanos). Estos sarcomas pueden haber sido consecuencia de la hipercolesterolemia, una respuesta a la administración crónica de itraconazol observada en ratas pero no en perros ni en humanos.
Se observó un aumento de la incidencia de carcinoma de células escamosas de pulmón en ratas hembras que recibieron 50 mg/kg de itraconazol al día (6,25 veces la dosis máxima recomendada en humanos). Aunque la aparición de carcinoma de células escamosas en el pulmón es extremadamente infrecuente en ratas no tratadas, el aumento de la incidencia en este estudio no fue estadísticamente significativo. La solución oral de itraconazol y la inyección de itraconazol disponibles comercialmente contienen hidroxipropil-b-ciclodextrina (HP-b-CD) como excipiente. La HP-b-CD ha producido adenocarcinomas pancreáticos en estudios de carcinogenicidad en ratas, pero no se observaron efectos similares en un estudio de carcinogenicidad en ratones.
Se desconoce la relevancia clínica de este hallazgo. Basándose en comparaciones de superficies corporales, se ha estimado que los pacientes que reciben la dosis habitual de solución oral de itraconazol disponible comercialmente estarían expuestos a concentraciones de HP-b-CD equivalentes a 1,7 veces la exposición de la dosis más baja utilizada en el estudio con ratas.
Queda por determinar si los resultados de los estudios con animales en los que se utilizó HP-b-CD administrado por vía oral son aplicables al itraconazol administrado por vía parenteral.
Otras características del paciente
No se esperan efectos adversos debidos a interacciones medicamentosas en pacientes diabéticos que utilizan insulina y fármacos hipoglucemiantes orales que no son metabolizados por CYP3A4 (por ejemplo, tolbutamida, gliclazida, glibenclamida, glipizida y metformina). Se han revisado los datos farmacocinéticos y de seguridad de los ensayos clínicos y de la vigilancia postcomercialización para evaluar la seguridad de itraconazol en pacientes diabéticos con onicomicosis o dermatomicosis.
La vigilancia posterior a la comercialización, incluidos todos los informes de acontecimientos adversos en pacientes que tomaban itraconazol concomitantemente con insulina o un fármaco hipoglucemiante oral, reveló 15 informes sugestivos de hiperglucemia y nueve informes sugestivos de hipoglucemia. En la mayoría de los pacientes, el efecto antidiabético no cambió. De los ensayos clínicos en 189 pacientes diabéticos que tomaban itraconazol para diversas infecciones, se registró un acontecimiento adverso relacionado con el itraconazol; se trataba de un agravamiento de la diabetes en un paciente con trasplante renal que también tomaba ciclosporina.
El itraconazol ha causado anomalías en el desarrollo del feto en roedores , por lo que está contraindicado en el embarazo.
Itraconazol debe evitarse en pacientes con insuficiencia hepática. Debe controlarse la función hepática si el tratamiento dura más de un mes o si hay síntomas sugestivos de hepatitis. El tratamiento debe interrumpirse si se detectan alteraciones de la función hepática.
Las concentraciones plasmáticas de ritraconazol deben controlarse en pacientes con enfermedad hepática activa, y la dosis debe ajustarse si es necesario. También puede ser necesario ajustar la dosis en algunos pacientes con insuficiencia renal. La información autorizada del producto advierte que el uso de preparados intravenosos de itraconazol formulados con hidroxipropilbetadex está contraindicado en pacientes con un aclaramiento de creatinina inferior a 30 ml/minuto.
Itraconazol debe suspenderse si se desarrolla neuropatía. No debe utilizarse para tratar infecciones fúngicas menos graves, como la onicomicosis, en pacientes con evidencia o antecedentes de disfunción ventricular, como insuficiencia cardiaca. La hipoclorhidria, que puede estar presente en pacientes con SIDA, puede reducir la absorción de itraconazol. En este caso, la absorción puede mejorarse administrando itraconazol con una bebida ácida, como una bebida de cola.
Marcas disponibles en España
En España, el itraconazol se comercializa bajo varios nombres comerciales, entre los que se incluyen
-
Sporanox;
-
Itraconazol Cinfa;
-
Itraconazol Sandoz;
-
Itraconazol Kern Pharma;
-
Itraconazol Teva.
Estas marcas ofrecen varias formulaciones para satisfacer las diferentes necesidades de los pacientes.
Usted puede ordenar Itraconazol en línea, y será entregado por SEUR, Correos, MRW, NACEX, GLS, Envialia, UPS y DHL.
Medicamentos antimicóticos similares
En España, otros antifúngicos similares al Itraconazol son
-
Fluconazol;
-
Voriconazol;
-
Posaconazol;
-
Ketoconazol.
Estos medicamentos también se utilizan para tratar diversas infecciones fúngicas y pueden considerarse alternativas en función de escenarios clínicos específicos.
Preparados
| Forma farmacéutica | Dosis | Marca comercial | Composición/Características | Fabricante |
|---|---|---|---|---|
| Cápsulas orales | 100 mg | Sporanox | Disponible en envases PulsePak® y normal | Janssen |
| Solución oral | 10 mg/mL | Sporanox | Contiene hidroxipropil-β-ciclodextrina (400 mg/mL) y propilenglicol | Ortho Biotech |
| Parenteral para inyección | 10 mg/mL (concentrado de 250 mg para administración IV de 200 mg) | Sporanox | Contiene hidroxipropil-β-ciclodextrina (400 mg/mL), propilenglicol y diluyente de cloruro sódico al 0,9%; incluye un equipo de infusión filtrado | Ortho Biotech |
Otras marcas en diferentes países
| País | Nombre de la marca |
|---|---|
| Argentina | ITC, Itrac, Micotenk, Nitridazol, Panastat, Salimidin, Sporanox |
| Australia | Sporanox |
| Austria | Itrabene, Sporanox |
| Bélgica | Sporanox |
| Brasil | Es-tiranox, Fungonax, Itracotan, Itrahexal-H, Itranax, Itraspor, Itrazol, Neo Itrax, Sporanox, Spozol, Tracnox, Traconal, Traconax, Tracozon, Trana-zol, Tratzol, Traxonol |
| Canadá | Sporanox |
| Chile | Itodal, Sporanox, Teramic |
| República Checa | Cladostad, Prokanazol, Sporanox |
| Dinamarca | Niddazol, Sporanox |
| Finlandia | Sporanox |
| Francia | Sporanox |
| Alemania | Canifug, Itra, Itracol, Sempera, Siros |
| Grecia | Assosept-S, Bevonazol, Brovicton, Deratil, Etrel, Flunol, Idranox, Isoflon, Itrabest, Itracon, Itraconal, Itralfa, Itraviron, Itrazol, Laverio, Lorenzol, Mesmor, Micronazol, Prominox, Soprazon, Sporanox, Sporizole, Stas, Sterginox, Zetilox |
| Hong Kong | Aranox, Quali-itrazole, Sporanox |
| Hungría | Cladostad, Omicral, Orungal |
| India | Candistat, Canditral, Itracan |
| Indonesia | Forcanox, Fungitrazol, Furolnok, Itzol, Nufatrac, Sporacid, Sporanox, Spyrocon, Trachon, Unitrac, Zitrazol |
| Irlanda | Sporanox |
| Israel | Itranol, Sporanox |
| Italia | Sporanox, Trazer, Triasporin |
| Malasia | Canditral, Inox, Sporanox, Unitrac |
| México | Carexan, Conamed, Congox, Derusil, Ergospharma, Fitocyd, Fulzoltec, Fuzoltec, Imazol, Iqcona, Isoporum, Isox, Itranax, Lozartil, Rixtal, Seritral, Silicsan, Sinozol, Solmavin, Sporanox, Steitraz, Trax, Z-Fin, Zolken |
| Países Bajos | Trisporal |
| Noruega | Sporanox |
| Nueva Zelanda | Sporanox |
| Filipinas | Sporanox |
| Polonia | Orungal, Trioxal |
| Portugal | Sporanox |
| Rusia | Irunine, Orungal, Orungamin, Orunit, Rumycoz |
| Sudáfrica | Adco-Sporozole, Sporanox |
| Singapur | Canditral, Sporanox |
| España | Canadiol, Hongoseril, Oromic, Sporanox |
| Suecia | Sporanox |
| Suiza | Sporanox |
| Tailandia | Canditral, Icona, Itra, Itracon, Norspor, Spazol, Sporal, Sporlab, Spornar |
| Turquía | Funit, Itraspor, Sporex |
| Reino Unido | Sporanox |
| Estados Unidos | Sporanox |
| Venezuela | Fungosina, Sporanox |
Multiingredientes
- México Sepia Sporasec
- Venezuela: Sporasec Sporasec
Puede pedir este medicamento online y pagar con una de las principales plataformas de pago online españolas además de tarjetas de crédito/débito y PayPal son Sepa Domiciliación Bancaria, Trustly, Paysafecard y Satispay.

